
| 39.2g |
| 98g/mol |
| n |
| V |
| 39.2g |
| 98g/mol |
| 1.2mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、从海带中提取碘单质的过程涉及氧化还原反应 |
| B、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| C、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| D、绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性 |
| C、若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
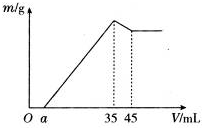
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
| 1 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量的氨水Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、用氨水吸收过量的二氧化硫NH3?H2O+SO2═NH4++HSO3- |
| C、向偏铝酸钠溶液中加入过量稀盐酸水AlO2-+H++H2O═Al(OH)3↓ |
| D、次氯酸钙溶液中通入过量的二氧化碳ClO-+CO2+H2O═HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

 的合成路线如图2:[( )内为反应类型,
的合成路线如图2:[( )内为反应类型, 内为目标产物]
内为目标产物] 内物质的结构简式:Ⅰ
内物质的结构简式:Ⅰ查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com