
����Ŀ����������(NaN3)��һ��������ˮ�İ�ɫ���壬�����Ҵ������������ѣ������ںϳɿ�����ͷ�߾���ҩ����м��塢������ȫ���ҵ�ҩ���ȡ�������(NaNH2)���۵�Ϊ210�棬�е�Ϊ400�棬��ˮ��Һ����ˮ�⡣ʵ������ȡ�������Ƶ�ʵ�鲽�輰ʵ��װ�����£�
�ٴ�ֹˮ��K1���ر�ֹˮ��K2������װ��Dһ��ʱ�䣻
�ڼ���װ��A�еĽ����ƣ�ʹ���ۻ�����ַ�Ӧ����ֹͣ����װ��D���ر�K1��
����װ��A��b�����ڳ�����Ƚ��ʲ����ȵ�210��220�棬��ֹˮ��K2��ͨ��N2O��
����ȴ��������м����Ҵ�����ѹŨ���ᾧ���ٹ��ˣ���������ϴ�ӣ����ɡ�

�ش��������⣺
(1)װ��B��ʢ�ŵ�ҩƷΪ____________��װ��C����Ҫ������________________��
(2)�������ۻ����Ʒ�Ӧ����NaNH2�Ļ�ѧ����ʽΪ__________��
(3)������У�Ϊ��ʹ��Ӧ���Ⱦ��ȣ�Aװ����a�����ļ��ȷ�ʽΪ_____������NaN3�Ļ�ѧ����ʽΪ_____��N2O����NH4NO3��240~245��ֽ��Ƶ�(����淋��۵�Ϊ169.6��)������ѡ������巢��װ����________(�����)��

(4)ͼ������a�õ������ʶ����ò���������Ҫԭ����_____________���������������ϴ�ӵ���ҪĿ����_______________��
(5)ʵ�����õζ����ⶨ����������Ʒ��NaN3�������������ٽ�2.500g�������500.00mL��Һ����ȡ50.00mL��Һ������ƿ�У�����50.00mL0.1010mol��L-1(NH4)2Ce(NO3)6��Һ���۳�ַ�Ӧ����Һ��ϡ�ͣ�����Һ�м���8mLŨ���ᣬ����3���ڷƆ���ָʾҺ����0.0500mol��L-1(NH4)2Fe(SO4)2����Һ�ζ�������Ce4+������Һ���Ϊ29��00mL���ⶨ���̵ķ�Ӧ����ʽΪ��
![]()
![]()
��������NaN3����������Ϊ_______________��
���𰸡���ʯ�ң����������ƹ��壩 ��������������а�����ˮ 2Na+2NH3![]() 2NaNH2+H2 ��ԡ NaNH2+N2O
2NaNH2+H2 ��ԡ NaNH2+N2O![]() NaN3+H2O �� ��Ӧ�����п������ɵ�NaOH�ܸ�ʴ���� NaN3���������ѣ��ܼ���NaN3���ܽ���ģ��������ӷ��������ڲ�Ʒ���ٸ��� 93.60%
NaN3+H2O �� ��Ӧ�����п������ɵ�NaOH�ܸ�ʴ���� NaN3���������ѣ��ܼ���NaN3���ܽ���ģ��������ӷ��������ڲ�Ʒ���ٸ��� 93.60%
��������
(1)����NaN3������ˮ���Ʊ����̲�����ˮ�IJ��������
(2)�������ۻ����Ʒ�Ӧ����NaNH2��������
(3)���ݲ���۵��¶�Ϊ210��220��ѡ����ȷ�ʽ��NaNH2��N2O����NaN3��ˮ���ݴ���д��Ӧ�ķ���ʽ������淋��۵�Ϊ169.6������NH4NO3��240��245���ֽ⣬Ϊ��ֹ������ۻ������Թܵײ����ݴ�ѡ�����巢��װ�ã�
(4)a���п�������NaOH�������������Ƶ����ʷ�����𣻸�����NaN3��������ˮ�İ�ɫ���壬�����Ҵ���������������������
(5)(NH4)2Ce(NO3)6������������Ʒ�Ӧ��ʣ���(NH4)2Ce(NO3)6��(NH4)2Fe(SO4)2����Һ�ζ������ݷ�Ӧ��Ce4++Fe2+=Ce3++Fe3+�����뷴Ӧ��(NH4)2Ce(NO3)6���Һ�����ʵ�����ȣ���˼�����������Ʒ�Ӧ��(NH4)2Ce(NO3)6���ݴ˷������㡣
(1)NaN3������ˮ�����Ʊ����̲�����ˮ��D���Ʊ��İ�������ˮ��������Bװ��ʢ�ż�ʯ��(���������ƹ���)���ﰱ������װ��C���������ˮ���ʴ�Ϊ����ʯ��(���������ƹ���)����������������а�����ˮ��
(2)��������ȼ���ͨ�������ž�װ���еĿ�������ֹ�����е�ˮ�����Ͷ�����̼�������Ʒ�Ӧ���������ۻ����Ʒ�Ӧ����NaNH2����������Ӧ�Ļ�ѧ����ʽΪ��2Na+2NH3![]() 2NaNH2+H2���ʴ�Ϊ��2Na+2NH3
2NaNH2+H2���ʴ�Ϊ��2Na+2NH3![]() 2NaNH2+H2��
2NaNH2+H2��
(3)����۵��¶�Ϊ210��220������ѡ����ԡ���ȣ�NaNH2��N2O����NaN3�ķ�ӦΪ��NaNH2+N2O![]() NaN3+H2O������淋��۵�Ϊ169.6������NH4NO3��240��245���ֽ⣬Ϊ��ֹ������ۻ������Թܵײ�����ѡ������巢��װ����I����������ѡ������Ϊ���巢��װ�ã��ʴ�Ϊ����ԡ���ȣ�NaNH2+N2O
NaN3+H2O������淋��۵�Ϊ169.6������NH4NO3��240��245���ֽ⣬Ϊ��ֹ������ۻ������Թܵײ�����ѡ������巢��װ����I����������ѡ������Ϊ���巢��װ�ã��ʴ�Ϊ����ԡ���ȣ�NaNH2+N2O![]() NaN3+H2O������
NaN3+H2O������
(4)a���п�������NaOH���ḯʴ������������a�õ������ʶ����ò����������֪��NaN3���������ѣ��ܼ���NaN3���ܽ���ģ��������ӷ��������ڲ�Ʒ���ٸ����������ϴ�Ӳ�Ʒ���ʴ�Ϊ����Ӧ�����п������ɵ�NaOH�ܸ�ʴ������NaN3���������ѣ��ܼ���NaN3���ܽ���ģ��������ӷ��������ڲ�Ʒ���ٸ��
(5)(NH4)2Ce(NO3)6���ܵ����ʵ���Ϊ��0.1010mol/L��50��10-3L=0.00505mol��������������Ʒ�Ӧ��ʣ���(NH4)2Ce(NO3)6��(NH4)2Fe(SO4)2����Һ�ζ������ݷ�Ӧ��Ce4++Fe2+=Ce3++Fe3+�����뷴Ӧ��(NH4)2Ce(NO3)6���Һ�����ʵ�����ȣ�Ϊ��0.0500mol/L��29.00��10-3L = 0.00145mol������������Ʒ�Ӧ��(NH4)2Ce(NO3)6��0.00505mol-0.00145mol=0.0036mol�����ݷ�Ӧ�У�NaN3��(NH4)2Ce(NO3)6����2.500g�����е������Ƶ�����Ϊ��0.0036mol��65g/mol��![]() =2.34g��������NaN3����������Ϊ
=2.34g��������NaN3����������Ϊ![]() ��100%=93.60%���ʴ�Ϊ��93.60%��
��100%=93.60%���ʴ�Ϊ��93.60%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeSO4��һ�ֲ�Ѫ���������¾����ױ�ƣ�һ����Ϊ�Ƕ�����������Ϊ��������Ե�ʡ�
��1����֪����Fe2+(aq)-e-= Fe3+(aq) ��H1=akJ/mol
��O2(g)+4 e-+4H+(aq)=2H2O(l) ��H2=bkJ/mol
��FeSO4��������Һ�б��ʵ��Ȼ�ѧ����ʽΪ_____ ��
�����£�����Ũ��Ϊ0.1mol/L��FeSO4��Һ���о���ͬ pH ��Fe2+ ������Ӱ�죬�������ͼ��ʾ�������跴Ӧ��������Һ������䣩��

��2����pH=5.5�Ļ����£��÷�Ӧ��0��15min��ƽ������v��Fe2+��=_______��������ҺpH��Fe2+����������_______������������������С��������Ӱ��������
��3����ƽ�ⳣ���ļ�������̬���ʳ���ѹǿ������Ũ�ȣ�Fe2+�����Ի�����������ƽ�ⳣ��K�ļ������ʽ��______�������¸÷�Ӧ��ƽ�ⳣ���ܴ�Ϊ2.5��1032L4 /(atmmol4)������˵����ȷ����_______��
a. Fe2+ת��ΪFe3+�����ƴ� b. Fe2+ת��ΪFe3+�����ʴ�
c. ��Ӧ���еý�Ϊ���� d. ����������Fe2+���ᱻ����
��4����pH=13�Ļ����£�Fe2+���������ʿ�������Ϊ��
��һ���� Fe2++2OH-= Fe(OH)2���ڶ���_____________ ���û�ѧ����ʽ�ش𣩣��������ﵽƽ��ʱ��c(Fe2+)/ c(Fe3+)_____4.0��1022������>����<������=��������֪��Ksp[Fe(OH)3]=2.5��10-39��Ksp[Fe(OH)2]=1.0��10-15��
��5��������������������FeSO4��Һ����ȷ�����Ǽ������������ۺ�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ļ���������ܱ������з�����Ӧ mA��g��+nB��g��![]() pC��g���ﵽƽ����¶Ȳ��䣬�����������С��ԭ����1/3���ﵽƽ��ʱ��C��Ũ��Ϊԭ����2.5����������˵����ȷ����
pC��g���ﵽƽ����¶Ȳ��䣬�����������С��ԭ����1/3���ﵽƽ��ʱ��C��Ũ��Ϊԭ����2.5����������˵����ȷ����
A. C������������� B. A��ת���ʽ���
C. ƽ��������Ӧ�����ƶ� D. m+n��p
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ������Һ�����ӹ�ϵ��˵����ȷ����(���� )
A. 0.1 mol��L��1NaHCO3��Һ������Ũ�ȹ�ϵ��c(Na��)��2c(![]() )��c(
)��c(![]() )��c(H2CO3)
)��c(H2CO3)
B. ��0.2 mol/L NH4Cl��Һ��0.1 mol/L NaOH��Һ�������Ϻ�����Ũ�ȹ�ϵ��c(Cl��)��c(![]() )��c(H��)��c(OH��)
)��c(H��)��c(OH��)
C. ���£����������Һ�еμ���������ʹ��pH=7������Һ�У�c(Na��)��c(CH3COO��)
D. ��Na2CO3��Һ�У�c(H��)��c(![]() )��c(H2CO3)= c(OH��)
)��c(H2CO3)= c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���Һ���������м������ɲ����գ����Եõ������ʱ�������(�� ��)
��CuSO4����KHCO3����FeSO4����NH4Cl����MgSO4����AlCl3 ��
A. �٢� B. �٢� C. �٢ۢ� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ļ������ڹ�ũҵ�����������о�����ҪӦ�á���ش�����������
(1)���������г���N2H4��Ϊ����������ȼ����N2H4�백�����ƣ���һ�ּ������壬������ˮ����������N2H4��H2O���õ��뷽��ʽ��ʾN2H4��H2O�Լ��Ե�ԭ�� ��
��2���ں��������£�1 mol NO2������C������Ӧ:2NO2(g)+2C(s)![]() N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A) Kc(B)�������������=������
��A��B��C������NO2��ת������ߵ��� ������A������B������C��������
������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp= ���г�����ʽ����������Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�����������
��3��������ĵ���ƽ�ⳣ��Ka=5.1��10-4��298K�����������ʺ���������ơ�
����֪298K ʱ��H2CO��Ka1=4.2��10-7 ��Ka2=5.61��10-11������2mol̼���Ƶ���Һ�м���1mol��HNO2������Һ��CO32-��HCO3-��NO2-������Ũ���ɴ�С�� ��
����10mL0.1mol/L����������Һ���뵽10mL0.1mol/L��ˮ����֪��25��ʱ��һˮ�ϰ���Ki= 1.8��10-5����,���������ҺΪ________��������������������������������������
��4��һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£�
��CaSO4��s��+CO��g��![]() CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
��CaSO4��s��+ 4CO��g��![]() CaS��s��+ 4CO2��g�� ��H = -189.2kJmol-1
CaS��s��+ 4CO2��g�� ��H = -189.2kJmol-1
��ӦCaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) ��H= kJmol-1��
CaS(s)+3CO2(g) ��H= kJmol-1��
(5)H2S��������ˮ�γɵ���������һ�ֶ�Ԫ���ᣬ25��ʱ����0.10 mol��L-1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2-)��ϵ��ͼ��ʾ(������Һ����ı仯��H2S�Ļӷ�)��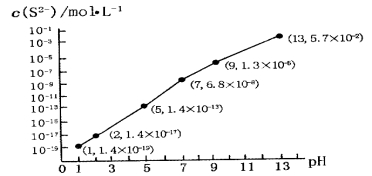
��pH=13ʱ����Һ�е�c(H2S)+c(HS-)=__________mol��L-1��
��ij��Һ��0.010 mol��L-1Fe2+��0.10 mol��L-1H2S������ҺpH=______ʱ��Fe2+��ʼ����������֪��KSP(FeS)=1.4��10-19��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ճ������е�һ�ֻ���
(1)�����йؽ����˵���У�����ȷ������___________��
A. ���塢��Һ����Һ�ķ��������Ƿ�ɢ����ֱ����С
B. ��±ˮ�㶹���������ƺ��뺣�ڴ���ɳ�������뽺��ľ۳��й�
C. ��1 mol/L�Ȼ�����Һ�м���������NaOH��Һ��ȡ������������
D. �����ö����������������ͭ��Һ��������������
(2)��ˮ���ұ��ҵ���ø�ѹ������ܽ����ó�ȥ�����̳����Լ��ٶԿ�������Ⱦ����������Ӧ�õ�ԭ����______��
(3)ij����С�����Fe��OH��3������Ʊ�ʵ�鲢������������ʡ�
��д���Ʊ�Fe��OH��3����Ļ�ѧ��Ӧ����ʽ:________��
��ȡ�����ƵõĽ�������Թ���,�ټ������������Ȼ�����Һ,�۲쵽������____�����������Ϊ�����____��
��![]() �������ȶ����ڵ���Ҫԭ����____________��
�������ȶ����ڵ���Ҫԭ����____________��
A.����ֱ��С��1nm B.����������� C.�����������˶� D.����������ֽ
(4)�й��Ʊ�Fe��OH��3����ʵ�鷽�����ۡ�ijͬѧ���Ʊ�Fe��OH��3����ʱ������ˮ��Ϊ����ˮ��к����ʵ�飬��ͬѧ�Ƿ��ܵõ����壿______�����ܻ��ܣ�����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O5��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע��һ���¶��£���2 L�̶��ݻ����ܱ������з�����Ӧ��2N2O5(g)![]() 4NO2(g)��O2(g)����H>0����Ӧ��Ͳ�������������ʵ����淴Ӧʱ��仯��������ͼ��ʾ������˵���в���ȷ
4NO2(g)��O2(g)����H>0����Ӧ��Ͳ�������������ʵ����淴Ӧʱ��仯��������ͼ��ʾ������˵���в���ȷ

A. ����a��ʾNO2�����ʵ�����ʱ��ı仯
B. 10 sʱ��v(��)>v(��)
C. 20 sʱ��Ӧ�ﵽƽ��
D. 0��20 s��ƽ����Ӧ���� v(O2)��0.05 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������װ����ȷ����

A. ����ͼ1��ʾװ��������ȡ�����������������β��
B. ����ͼ2��ʾװ����ȡ��ϩ
C. ����ͼ3��ʾװ��֤��H2CO3����ǿ�ڱ���
D. ����ͼ4��ʾװ���Ʊ���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com