
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |

 下列说法错误的是:
下列说法错误的是:


 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50% B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600 C.增大压强使平衡向生成Z的方向移动,平衡常数减小
C.增大压强使平衡向生成Z的方向移动,平衡常数减小 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数科目:高中化学 来源:不详 题型:单选题
 N2O4(g),达到平衡后,再向该容器中充入amol NO2,达到平衡后与原来平衡比较正确的是( )
N2O4(g),达到平衡后,再向该容器中充入amol NO2,达到平衡后与原来平衡比较正确的是( )| A.NO2的转化率提高 | B.颜色变浅 |
| C.压强为原来的两倍 | D.平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
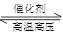 2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20 MPa—50 MPa,温度:500 ℃左右,催化剂:铁触媒。下列有关合成氨工业的叙述不正确的是
2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20 MPa—50 MPa,温度:500 ℃左右,催化剂:铁触媒。下列有关合成氨工业的叙述不正确的是| A.使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率 |
| B.工业上选择上述条件下合成氨,可以使氮气全部转化为氨 |
| C.上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响 |
| D.温度升高,不利于氮气的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.溴水中有平衡:Br2+ H2O  HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
B.对CO(g) + NO2 (g) CO2 (g)+ NO(g) 平衡体系,增大压强可使颜色变深 CO2 (g)+ NO(g) 平衡体系,增大压强可使颜色变深 |
| C.工业上合成SO3,使用催化剂 |
| D.合成 NH3反应,在较高温度下进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
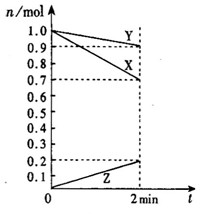
 cC(g)+dD(g),1 min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为: ;C的浓度为: 。在这段时间内反应速率若以物质A的浓度变化来表示,应为__________。
cC(g)+dD(g),1 min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为: ;C的浓度为: 。在这段时间内反应速率若以物质A的浓度变化来表示,应为__________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
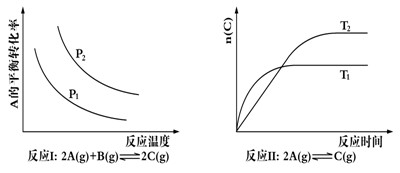
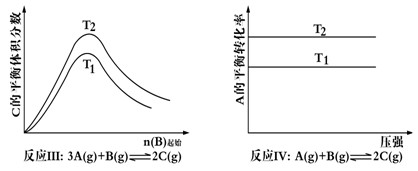
| A.反应Ⅰ△H> 0,P2>P1 | B.反应Ⅱ△H<0,T1>T2 |
| C.反应Ⅲ△H> 0,T2>T1;或△H<0,T2<T1 | D.反应Ⅳ△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2O(g) + CO(g) (ΔH>0)的平衡常数
H2O(g) + CO(g) (ΔH>0)的平衡常数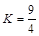 ,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:| 起始浓度(mol/L) | 甲 | 乙 | 丙 | 丁 |
| c(H2) | 0.01 | 0.02 | 0.02 | 0.005 |
| c(CO2) | 0.01 | 0.01 | 0.02 | 0.005 |
| c(H2O) | 0 | 0 | 0 | 0.005 |
| c(CO) | 0 | 0 | 0 | 0.005 |
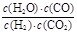 值最小
值最小查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
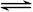 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 HSO3-+OH-水解平衡的事实是 _(填序号)。
HSO3-+OH-水解平衡的事实是 _(填序号)。
 2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com