
| A. | 向平衡体系中加入水,平衡正向移动,c (H+)增大 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量硫酸氢钠固体,$\frac{c({H}^{+})}{c(O{H}^{-})}$增大 | |
| D. | 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低 |
分析 A.水的电离达到平衡:H2O?H++OH-,如改变溶液中c(H+)或c(OH-),平衡可发生移动;
B.水的电离是吸热反应,升高温度,氢离子浓度增大,pH减小;
C.硫酸氢钠是强电解质,溶于水电离出氢离子,溶液中氢离子浓度增大;
D.氢氧化钠是强碱,加入后溶液中的氢氧根离子浓度增大,平衡逆向移动.
解答 解:A.向平衡体系中加入水,温度不变,加入的水与原水的电离平衡一样,c(H+)、c(OH-)都不变,平衡不移动,故A错误;
B.水的电离△H>0,反应吸热,温度升高,平衡正向移动,溶液中氢离子浓度增大,pH降低,故B错误;
C.由于硫酸氢钠是强电解质,加入水后,溶液中的氢离子浓度增大,平衡虽向逆向移动,但溶液中的氢离子浓度因硫酸氢钠的电离增大,温度不变KW=c(H+)×c(OH-)不变,c (OH-)减小,所以$\frac{c({H}^{+})}{c(O{H}^{-})}$增大,故C正确;
D.NaOH电离的氢氧根重力使溶液中氢氧根离子浓度增大,平衡逆向移动,c(H+)降低,故D错误;
故选C.
点评 本题考查外界条件对弱电解质水的电离平衡的影响,注意加入酸、碱,平衡逆向移动,但是溶液中的氢离子或者氢氧根浓度反而增大,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1molNH5中含有5NA个N-H键 | |
| B. | NH5中既含有共价键,又含有离子键,是离子化合物 | |
| C. | NH5的熔、沸点高于NH3 | |
| D. | NH5固体投入少量水中可产生两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤粉碎后燃烧 | B. | 通入大量的空气 | ||
| C. | 加入的煤越多越好 | D. | 将煤和空气在密闭的空间里燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定没有离子键 | |
| B. | 单质中一定没有离子键,一定有共价键 | |
| C. | 共价键通过原子之间得失电子形成 | |
| D. | 非金属元素组成的化合物中不可能有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 60gSiO2中含Si-O键的个数为2NA | |
| C. | 12 g石墨中含有C-C键的个数为1.5NA | |
| D. | 36 g戊烷中共价键的个数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>Br | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 碱性:KOH>NaOH | D. | 热稳定性:NH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素元素在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量最多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物均有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
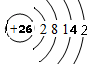 ;
; ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
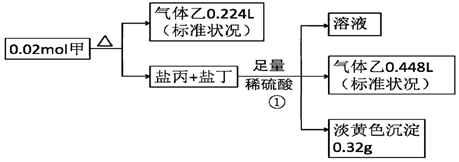
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com