
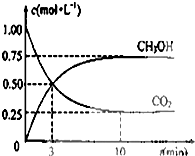
 ��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸������ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·������·�Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸������ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·������·�Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��| ��c |
| ��t |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 0.75mol/L |
| 10min |
| n(CH3OH) |
| n(CO2) |
| n(CH3OH) |
| n(CO2) |
| n(CH3OH) |
| n(CO2) |
| n(CH3OH) |
| n(CO2) |
| n(CH3OH) |
| n(CO2) |
| n(CH3OH) |
| n(CO2) |


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1L 1.0 mol?L-1��NaAlO2ˮ��Һ�к���AlO2-ΪNA |
| B��1mol Na����ȫ��������Na2O2��һ��ʧȥNA������ |
| C��1L 1 mol?L-1�����Ậ��NA��HCl���� |
| D����״���£�6.72 L NO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������CO2ͨ�백ˮ�У�CO2+NH3?H2O=NH4++HCO3- |
| B����Na2CO3��Һ��ε��������У�2H++CO32-=CO2��+H2O |
| C��SO2ʹ��ɫʯ����Һ���ɫ��SO2+H2O?2H++SO32- |
| D������������ϡ���ᷴӦ��Fe+4H++NO3-=Fe3++2H2O+NO�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���� | B���� | C���� | D��þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 SO2ͨ��BaCl2��Һ�в���������������ͨ����һ���������Բ�����ɫ��������ͼ���Ҳ�Y�ι��з��õ�ҩƷ��ϲ�����Ҫ����ǣ���Ҫ�ǿ��Լ��ȣ���������
SO2ͨ��BaCl2��Һ�в���������������ͨ����һ���������Բ�����ɫ��������ͼ���Ҳ�Y�ι��з��õ�ҩƷ��ϲ�����Ҫ����ǣ���Ҫ�ǿ��Լ��ȣ���������| A��Cu��Ũ���� |
| B��CaO��Ũ��ˮ |
| C������ʯ��ϡ���� |
| D�����������Һ��Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
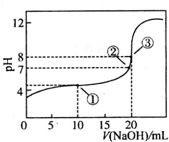 ��25��ʱ����50.00mLδ֪Ũ�ȵ�CH3COOH��Һ����μ���0.5mol?L-1��NaOH��Һ���ζ������У���Һ��pH�����NaOH��Һ����Ĺ�ϵ����ͼ��ʾ��������˵���У�����ȷ���ǣ�������
��25��ʱ����50.00mLδ֪Ũ�ȵ�CH3COOH��Һ����μ���0.5mol?L-1��NaOH��Һ���ζ������У���Һ��pH�����NaOH��Һ����Ĺ�ϵ����ͼ��ʾ��������˵���У�����ȷ���ǣ�������| A���ٵ���ʾ��Һ�ĵ����������ڢڵ� |
| B��ͼ�е����ʾ��Һ�У�c��CH3COO-����c��Na+�� |
| C��ͼ�е����ʾ��Һ��ˮ�ĵ���̶ȴ��ڵ����ʾ��Һ��ˮ�ĵ���̶� |
| D���ζ������е�ij�㣬����c��Na+��=c��CH3COO-����c��H+��=c��OH-���Ĺ�ϵ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com