
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)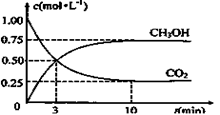
 CH3OH(g)+H2O(g)和化学平衡常数的定义写出该反应的平衡常数表达式:K=c(CH3OH)c(H2O)/c(CO2)c3(H2);已知:K(300℃)>K(350℃),则升高温度,平衡逆向移动,升高温度,平衡向吸热反应方向移动,则该反应是放热反应;(2)A、根据M=m/n判断,随着反应的进行,混合气体的质量不变,物质的量发生变化,混合气体的平均相对分子质量不断变化,当混合气体的平均相对分子质量不变,反应已达平衡状态,错误;B、根据阿伏加德罗定律,同温同体积条件下,气体的压强之比等于物质的量之比,随着反应的进行气体的物质的量不断变化,混合气体的压强不断变化,当混合气体的压强不变时,反应已达平衡状态,错误;C、单位时间内生成3mol H—H键,同时生成2 mol C=O键 ,二者均为逆反应速率,不能说明该反应一定达到平衡,正确;D、混合气体中 c (H2) : c (CH3OH) = 3:1[,不能说明该反应一定达到平衡,正确;选CD;(3)根据题给图像知,10min时反应达到平衡状态,甲醇的浓度变化为0.75mol·L—1,根据公式v=△c/△t计算,v(CH3OH)=0.075 mol·L-1·min-1,利用速率之比等于化学计量数之比计算,v(H2)= 3v(CH3OH)= 0.225 mol·L-1·min-1;(4)A、该反应为放热反应,升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小,错误;B、加入催化剂 ,平衡不移动,n(CH3OH)/n(CO2)不变,错误;C、将H2O(g)从体系中分离,平衡正向移动,n(CH3OH)/n(CO2)增大,正确;D、等温等容条件下,充入He(g),虽然体系总压强增大,但与反应相关的物质的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,错误;E、等温等容条件下,再充入1molCO2和3molH2相当于增大压强,平衡正向移动,n(CH3OH)/n(CO2)增大,正确,选CE;(5)若一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,随着反应的进行,容器内气体的物质的量不断减小,容器的体积不断减小,相当于增大压强,平衡正向移动,达到平衡时该容器中的CO2的体积百分数 < (3)题中的CO2的体积百分数。
CH3OH(g)+H2O(g)和化学平衡常数的定义写出该反应的平衡常数表达式:K=c(CH3OH)c(H2O)/c(CO2)c3(H2);已知:K(300℃)>K(350℃),则升高温度,平衡逆向移动,升高温度,平衡向吸热反应方向移动,则该反应是放热反应;(2)A、根据M=m/n判断,随着反应的进行,混合气体的质量不变,物质的量发生变化,混合气体的平均相对分子质量不断变化,当混合气体的平均相对分子质量不变,反应已达平衡状态,错误;B、根据阿伏加德罗定律,同温同体积条件下,气体的压强之比等于物质的量之比,随着反应的进行气体的物质的量不断变化,混合气体的压强不断变化,当混合气体的压强不变时,反应已达平衡状态,错误;C、单位时间内生成3mol H—H键,同时生成2 mol C=O键 ,二者均为逆反应速率,不能说明该反应一定达到平衡,正确;D、混合气体中 c (H2) : c (CH3OH) = 3:1[,不能说明该反应一定达到平衡,正确;选CD;(3)根据题给图像知,10min时反应达到平衡状态,甲醇的浓度变化为0.75mol·L—1,根据公式v=△c/△t计算,v(CH3OH)=0.075 mol·L-1·min-1,利用速率之比等于化学计量数之比计算,v(H2)= 3v(CH3OH)= 0.225 mol·L-1·min-1;(4)A、该反应为放热反应,升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小,错误;B、加入催化剂 ,平衡不移动,n(CH3OH)/n(CO2)不变,错误;C、将H2O(g)从体系中分离,平衡正向移动,n(CH3OH)/n(CO2)增大,正确;D、等温等容条件下,充入He(g),虽然体系总压强增大,但与反应相关的物质的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,错误;E、等温等容条件下,再充入1molCO2和3molH2相当于增大压强,平衡正向移动,n(CH3OH)/n(CO2)增大,正确,选CE;(5)若一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,随着反应的进行,容器内气体的物质的量不断减小,容器的体积不断减小,相当于增大压强,平衡正向移动,达到平衡时该容器中的CO2的体积百分数 < (3)题中的CO2的体积百分数。

科目:高中化学 来源:不详 题型:单选题
| A.放热反应,不必加热就一定能发生 |
| B.化学反应一定伴有能量变化 |
| C.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
| D.热化学反应方程式中,热效应数值与反应物的物质的量的多少有关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量 |
| B.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 |
| C.相同体积浓度均为0.1mol/L盐酸和醋酸溶液分别与足量的NaOH稀溶液反应,前者放出热量多 |
| D.氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.食品放在冰箱中贮藏 |
| B.双氧水制氧气时加入少量二氧化锰 |
| C.试管中进行镁和水反应时,稍微加热 |
| D.铁粉代替铁钉与稀硫酸反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
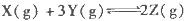 为放热反应,一定温度下在密闭容器中进行反应,
为放热反应,一定温度下在密闭容器中进行反应,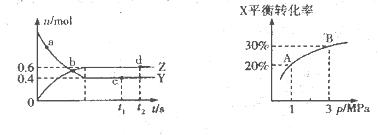
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
|
|
|
|
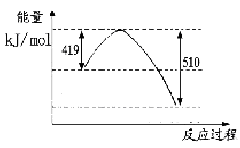 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。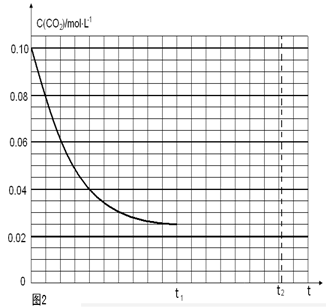
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com