
【题目】用含铁废铜制备胆矾的流程如下图所示:
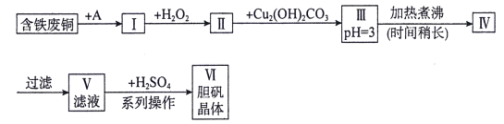
下列说法错误的是( )
A.物质A可选用盐酸
B.I中加H2O2的目的是溶解铜并将Fe2+氧化为Fe3+
C.长时间煮沸Ⅲ中悬浊液的目的是充分聚沉Fe(OH)3
D.“系列操作”包括蒸发浓缩,冷却结晶,过滤,洗涤
【答案】A
【解析】
含铁废铜制备胆矾,首先将金属溶解,A为稀硫酸,溶解除铜以外的其他金属;再加入强氧化性的过氧化氢,将铜溶解,同时将存在的亚铁离子氧化为铁离子,加入Cu2(OH)2CO3,调节溶液的pH,将铁变成氢氧化铁沉淀除去;最后进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有![]() ,加硫酸其目的是抑制Cu2+的水解,进行蒸发浓缩,冷却结晶,过滤,洗涤得到产品胆矾。
,加硫酸其目的是抑制Cu2+的水解,进行蒸发浓缩,冷却结晶,过滤,洗涤得到产品胆矾。
A. 物质A选用稀硫酸溶解除铜外的其他金属,不能是盐酸,会引入氯离子的杂质,A错误;
B. H2O2具有强氧化性,能将Fe2+氧化为Fe3+,也能在酸性环境下溶解铜,B正确;
C. 长时间加热煮沸的目的是充分聚沉Fe(OH)3,以便过滤除去,C正确;
D. 得到胆矾晶体的操作是蒸发浓缩,冷却结晶,过滤,洗涤,D正确;
故答案为:A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)天然气是一种清洁高效的能源,其主要成分为甲烷。
CH4的摩尔质量为_____________, 4.8 g CH4的物质的量为______________,在标准状况下的体积约为_______________,所含氢原子数为_______________。
(2)某化学兴趣小组对某矿泉水进行检测, 发现0.5 L该矿泉水中含有10.8 mg Mg2+,则Mg2+的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
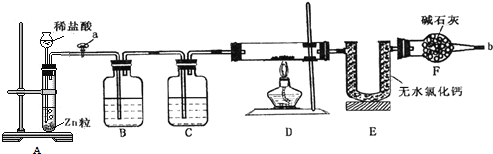
(1)实验前如何检验装置A的气密性________________________________________;
(2)为了实验安全,在点燃酒精灯前,在F装置出口b处必须_____________________;
(3)装置C中盛装的液体是浓硫酸,则装置B的作用是_________________________;
(4)U形管E右边又连接干燥管F的目的是___________。
(5)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U形管的质量增加7.2 g,则混合物中Fe2O3的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应不仅有物质变化,同时还伴随着能量的变化,化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)在25℃、101KPa下,1gCH3OH与氧气充分反应,生成二氧化碳气体和水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____。
(2)已知已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g液态水时放出的热量是__________ kJ(结果保留两位小数)
(3)已知热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220 kJ/mol,2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
①现有H2和C3H8的混合气体共5mol,完全燃烧时放热3472.9kJ,则混合气体中H2和C3H8的体积比为__________。
②1mol H2和2 mol C3H8组成的混合气体共完全燃烧时放热_________ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
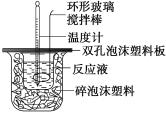
(1)烧杯间填满碎泡沫塑料的作用是_________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。
(5)倒入NaOH溶液的正确操作是 _________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对高温条件下反应机理的研究一直是化学动力学的重要课题,科研工作者研究了1000K下丙酮的热分解反应并提出了如下反应历程:
![]() ①
①![]()
![]() ②
②![]()
![]() ③
③![]()
![]() ④
④![]()
![]() ⑤
⑤![]()
回答下列问题:
(1)上述历程是根据两个平行反应提出的,其中一个为CH3COCH3![]() CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
(2)CH2=C=O(乙烯酮)可以与乙醇发生加成反应生成酯,写出该反应的化学方程式:____________________________________。
(3)一定温度下,在2L密闭容器中充入1molCH3COCH3发生上述两个平行反应,提高乙烯酮反应选择性的关键因素是___________;
a.再充入1molCH3COCH3 b.及时分离出CH4 c.使用适宜的催化剂
达到平衡后,测得容器中存在a molCH4和b mol CO,则CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
(4)分解产物中的CH4可用于制备氢气:
反应I:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=206.2kJ·mol-1
CO(g)+3H2(g) △H=206.2kJ·mol-1
反应Ⅱ:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=165.0kJ·mo1-1
CO2(g)+4H2(g) △H=165.0kJ·mo1-1
写出CO与水蒸气反应生成CO2的热化学方程式:_________________。830℃时,反应Ⅱ的平衡常数K=1.2mol2·L-2,该温度下,测得密闭容器中各物质的浓度为c(CH4)=2.0mol·L-1、c(H2O)=4.0mol·L-1、c(CO2)=2.0mol·L-1、c(H)=2.0mol·L-1,则此时v正_____v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)合成氨工艺(流程如图1所示)是人工固氮最重要的途径。2018年是合成氨工业先驱哈伯(F·Haber)获得诺贝尔奖100周年。
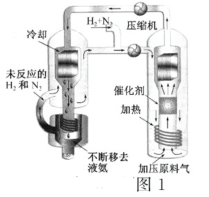
N2和H2生成NH3的反应为:![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)△H(298K)=-46.2kJ·mol-1
NH3(g)△H(298K)=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)![]() 2H*
2H*
表面吸附:N*+H*![]() NH*;NH*+H*
NH*;NH*+H*![]() NH2*;NH2*+H*
NH2*;NH2*+H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)利于提高合成氨平衡产率的条件有_______________
A.低温B.高温C.低压D.高压E.催化剂
(2)标准平衡常数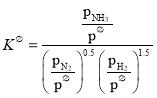 ,其中
,其中![]() 为标准压强1×105Pa,
为标准压强1×105Pa,![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() =
=![]() p,p为平衡总压,
p,p为平衡总压,![]() 为平衡系统中NH3的物质的量分数
为平衡系统中NH3的物质的量分数
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为ω,则![]() =____________(用含ω的最简式表示)
=____________(用含ω的最简式表示)
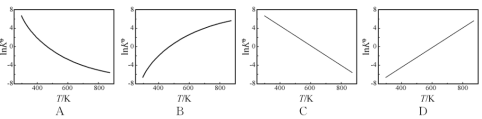
②图中可以示意标准平衡常数K随温度T变化趋势的是____________
(3)实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8
①分析说明原料气中N2过量的理由____________
②关于合成氨工艺的下列理解,正确的是____________
A.合成氨反应在不同温度下的△H和△S都小子零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
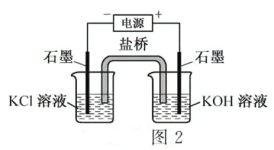
(二)高铁酸钾(K2FeO4)可用作水处理剂口某同学通过“化学一电解法”探究K2FeO4的合成,其原理如图2所示.接通电源,调节电压,将一定量C12通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4
(1)请写出“化学法”得到FeO42一的离子方程式____________
(2)请写出阳极的电极反应式(含FeO42-)____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com