
【题目】根据下图回答问题:

(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。______________________________________。
(2)写出浓硫酸和木炭粉加热条件下反应的化学方程式:_______________________
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:A中加入的试剂和作用是_____________________;B中加入的试剂和作用是__________________________;D中加入的试剂和作用是____。
(4)若C中装有KMnO4溶液,则实验时C中应观察到的现象是_________________。
【答案】 反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热后,水会升到导管里形成一段水柱,证明装置不漏气 2H2SO4(浓)+C![]() 2H2O+2SO2+CO2 无水硫酸铜,检验水 品红溶液,检验二氧化硫 澄清石灰水,检验二氧化碳 酸性高锰酸钾溶液的颜色不褪尽,证明SO2被除尽。
2H2O+2SO2+CO2 无水硫酸铜,检验水 品红溶液,检验二氧化硫 澄清石灰水,检验二氧化碳 酸性高锰酸钾溶液的颜色不褪尽,证明SO2被除尽。
【解析】(1)检查气密性时,由于装置较多,双手的热量不足以使整个装置中气体膨胀,效果不明显,因而在B、C、D洗气瓶的导管口见不到气泡冒出,所以在反应前用小火加热(或其他方法),使瓶内空气迅速膨胀,导致气泡从洗气瓶的导管中冒出,停止加热后,烧瓶冷却,瓶内压力减小,产生负压,水会升到洗气瓶的导管里,形成一段水柱,由此证明装置不漏气。
(2)浓H2SO4与木炭反应生成H2O(g),SO2(g),CO2(g)三种物质,化学方程式为:2H2SO4(浓)+C![]() 2H2O↑+2SO2↑+CO2↑。
2H2O↑+2SO2↑+CO2↑。
(3)可以用无水硫酸铜检验其中的H2O(g),白色无水CuSO4吸水后变为蓝色CuSO4·5H2O;SO2可以使品红溶液褪色;由于SO2和CO2都能使澄清石灰水变浑浊,所以要证明气体中有CO2,先要确认气体中已经不再有SO2。因此在装置中,容器A中的试剂是无水CuSO4、B中是品红溶液、D中是澄清石灰水。由于酸性KMnO4溶液具体强氧化性,而SO2具有还原性,两者可发生氧化还原反应,因此,C中可加入酸性KMnO4溶液,用来除去剩余的SO2气体。在实验时,C中应观察到的现象是酸性KMnO4溶液的颜色不褪尽,这样才能说明SO2已经除尽,使澄清石灰水变浑只能是气体中有CO2。
(4)由上述分析可得:酸性高锰酸钾溶液的颜色不褪尽,证明SO2被除尽。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略)。其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是

A. 原子半径的大小m>q>n>p
B. 元素非金属性q>n>p
C. Q的溶液可以保存在细口玻璃试剂瓶
D. n的氧化物的水化物一定为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A. (2b+2c-a) kJ·mol-1 B. (b+c-a) kJ·mol-1
C. (a-2b-2c) kJ·mol-1 D. (a-2b-c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实的解释中错误的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸具有吸水性
C. 常温下能够用铝罐储存浓硫酸,是因为浓硫酸的强氧化性可使铝发生钝化
D. 反应:C+2H2SO4(浓)![]() CO2↑+2H2O+2SO2↑中,H2SO4既体现酸性又体现了强氧化性
CO2↑+2H2O+2SO2↑中,H2SO4既体现酸性又体现了强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁被称为“国防金属”,镁及其合金用途很广,目前世界上60%的镁从海水中提取。从海水中提取镁的流程如下:
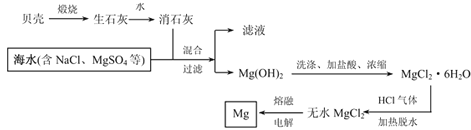
请根据上述流程图和镁及化合物的性质回答下列问题:
(1)用贝壳煅烧生石灰的反应方程式:________________
(2)氢氧化镁溶于盐酸的离子方程式为:_____________。
(3)简述,由MgCl2·6H2O制无水MgCl2,加热时通HCl气体的主要原因是:___________。
(4)金属镁属于(填写下列编号):___________。
a.黑色金属 b.有色金属 c.轻金属 d.重金属 e.贵金属
(5)Mg(OH)2煅烧可得熔点很高的MgO,MgO的电子式为:____________。
(6)MgCl2和AlCl3的熔点均较低,加MgO和Al2O3的熔点都很高。为什么冶炼金属镁是电解MgCl2,而冶炼金属铝则电解Al2O3:_______________。
(7)某MgCl2溶液的浓度为0.01mol/L,在该溶液中滴加NaOH溶液至pH=10,此时溶液中的Mg2+是否沉淀完全?_________(填“是”或“否”),此时c(Mg2+)=_________。
(已知:Ksp[Mg(OH)2]=1.8×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):

(1)若A是一种金属,C是淡黄色固体,则B的化学式为 _____________________,A→C反应的化学方程式为______________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最重要的温室气体,则C的分子式是___________,B→C反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是 ( )
A. BF3是三角锥形分子
B. NH![]() 的电子式:
的电子式: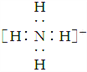 ,离子呈平面形结构
,离子呈平面形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D. 正三价阳离子的电子排布式为1s2 2s2 2p6 3s2 3p6 3d5的元素周期表中位于第Ⅷ族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com