
(共13分)I(7分)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
II(6分)燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”。
(4)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,其电池反应为 4NH3+3O2=2N2+6H2O
写出该燃料电池的正极反应式
(5)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。

①放电时,负极的电极反应式为:
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为:
(1)负;4Al2Cl7— + 3e— = Al + 7AlCl4— ;H2 (2) 3
(3)b、d;不能;Fe2O3+6H+ = 2Fe3+ + 3H2O Fe + 2Fe3+ = 3Fe2+
(4)O2 + 2H2O+ 4e— = 4OH—
(5)①CH4-8e—+10OH—= CO32—+7H2O ②c(K+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+)
【解析】
试题分析:(1)根据电解原理知,在钢制品上电镀铝,钢制品为镀件,作阴极,连接电源的负极;电镀铝阴极应生成单质铝,所以阴极电极反应式为:4 Al2Cl7—+3e?=Al+7 AlCl4—;若改用AlCl3水溶液作电解液,H2O电离产生的H+放电生成H2;(2)用NaOH溶液溶解钢制品表面的铝镀层的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑还原产物为H2,与转移电子的对应关系为:H2 ~ 2e?,n(H2)=1/2n(e?)=1/2×6mol=3mol;(3)铝热反应需要用Mg和KClO3提供高温条件,选b、d;H2SO4与Fe2O3反应可生成Fe3+,但铝热反应生成的Fe可将Fe3+还原为Fe2+,发生反应:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,加入KSCN,无明显现象;(4)NH3燃料电池,其电池反应为 4NH3+3O2=2N2+6H2O,该燃料电池的正极反应式O2 + 2H2O+ 4e— = 4OH—;(5)①碱性甲烷燃料电池放电时,甲烷在负极失电子,生成碳酸根,利用电荷守恒和原子守恒配平,电极反应式为:CH4-8e—+10OH—= CO32—+7H2O;②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL,物质的量为0.4mol,转移的电子为0.16mol,利用电子守恒知参加反应的甲烷为0.02mol,生成的二氧化碳为0.02mol,与100.0 mL 3.0 mol·L—1 KOH溶液反应后电解质溶液为等浓度的碳酸钾和碳酸氢钾的混合液,各离子浓度的大小关系为:c(K+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+)。
考点:考查电化学原理、氧化还原反应原理、铝热反应、离子浓度大小比较。


科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:实验题
(8分)溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
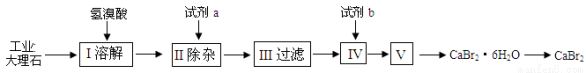
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的HBr 500ml,所需的玻璃仪器有玻璃棒、烧杯、量筒、 、 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 。步骤Ⅳ的目的是 。
(3)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤、洗涤、干燥、称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
②若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
[化学─选修5:有机化学基础](15分)
(一)2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”。下图是大麻的主要成分THC的结构式。

(1)该物质含有的官能团的名称为 ,它的分子式为 ,分子中手性碳原子数为 。
(2)下列关于THC的说法中正确的是
A.分子中含有苯环,属于芳香烃类化合物
B.难溶于水,易溶于乙醇、乙醚、苯和碱溶液
C.可以发生加成反应、取代反应、氧化反应、消去反应
D.除氢原子外,分子中所有的其它原子都在一个平面上
E.遇FeCl3溶液显紫色;可以使溴的四氯化碳溶液褪色
F.通常状态下,1mol该物质最多可与3mol Br2发生反应
(二)香豆素是重要的香料、医药中间体。某研究小组设计的合成香豆素路线如下:

提示:2CH3CHO+(CH3CO)2O 2CH3CH=CHCOOH+H2O
2CH3CH=CHCOOH+H2O
(1)A→B的化学方程式为 。
(2)D的核磁共振氢谱图中的吸收峰有 个。反应⑤的有机反应类型是 反应。H的结构简式为 。
(3)已知芳香族化合物I是G的同分异构体,且I的苯环上只有一个取代基。则I的结构简式可能为
。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:实验题
(15分)三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体。实验室合成三苯甲醇的实验装置如图所示。

已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
物质 | 沸点/℃ |
三苯甲醇 | 380 |
乙醚 | 34.6 |
溴苯 | 156.2 |
③三苯甲醇的相对分子质量为260。
请回答下列问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:

其中,操作①的名称是 ;洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:选择题
某有机物的结构简式为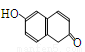 。下列关于该有机物的叙述正确的是
。下列关于该有机物的叙述正确的是
A.该有机物属于芳香烃
B.该有机物苯环上一氯代物有6种
C.该有机物可发生取代、加成、加聚、消去反应
D.1 mol该有机物在适当条件下,最多可与3 mol Br2、5 mol H2反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
已知:锂离子电池的总反应为:LixC+Li1-xCoO2 C+LiCoO2,锂硫电池的总反应为: 2Li+S
C+LiCoO2,锂硫电池的总反应为: 2Li+S Li2S。有关上述两种电池说法正确的是
Li2S。有关上述两种电池说法正确的是

A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.上图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
下列图像表达正确的是
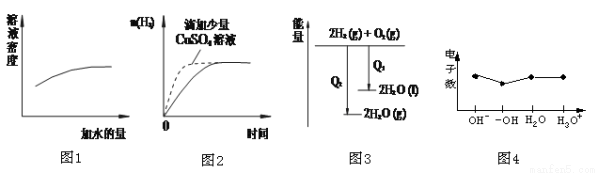
A.图1表示浓硫酸的稀释
B.图2表示过量的盐酸与等量的锌粉反应
C.图3表示氢气与氧气反应中的能量变化
D.图4表示微粒电子数
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等五校高三联考理综化学试卷(解析版) 题型:填空题
(16分)氮氧化物和SO2是造成雾霾天气的主要原因之一。
(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ·mol-1,C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1
写出焦炭与水蒸气高温反应的热化学方程式: 。
②洗涤含SO2的烟气。下列物质可作洗涤剂的是 (填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(2)①已知汽车发动机工作时汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) ΔH=+183kJ·mol-1。若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量增大的原因: 。
2NO(g) ΔH=+183kJ·mol-1。若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量增大的原因: 。
(3)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如图所示,图中气体流量计B用于准确测量通过的尾气体积。

将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
①洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是 。
②洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量________(填“偏高”、“偏低”或“无影响”)。
(4)将某PM2.5样本用蒸馏水处理制成待测试液。若测得该试液所含水溶性无机离子的化学组分及其平均浓度[c(H+)、c(OH-)待测]如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,待测试液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(文)试卷(解析版) 题型:?????
以下现象与电化学腐蚀有关的是
A.炒菜的铁锅容易生锈 B.生铁比纯铁容易生锈。
C.运输石油的管道表面变暗 D.银质奖牌(纯银制成)久置后表面变暗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com