
| A. | 0.1mol•L-1醋酸,溶液的pH=1 | |
| B. | 0.1mol•L-1醋酸加水稀释,溶液中离子浓度都减小 | |
| C. | 0.1mol•L-1氨水溶液中:c(OH-)=c(NH${\;}_{4}^{+}$) | |
| D. | 0.1mol•L-1氨水与0.1mol•L-1 HCl溶液等体积混合所得溶液中:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) |
分析 A.醋酸是弱电解质,在水溶液里部分电离;
B.加水稀释促进醋酸电离,但溶液中氢离子浓度减小,温度不变,水的离子积常数不变,据此判断氢氧根离子浓度;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.等物质的量的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,再结合电荷守恒判断.
解答 解:A.醋酸氨是弱电解质,在水溶液里部分电离,所以醋酸溶液中存在电离平衡,则0.1mol•L-1醋酸,溶液的pH>1,故A错误;
B.加水稀释促进醋酸电离,氢离子增多个数小于溶液体积增大倍数,所以溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(OH-)=c(NH4+)+c(H+),故C错误;
D.等物质的量的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),盐类水解较微弱,所以c(NH4+)>c(H+),该溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查了弱电解质的电离及盐类水解,常常与离子浓度大小比较联系考查,根据弱电解质电离特点及电荷守恒解答,易错选项是B,注意稀释醋酸时,醋酸溶液中只有氢氧根离子浓度增大,为易错点.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显酸性 | B. | NaH中氢离子电子层排布与氦相同 | ||
| C. | NaH中氢离子半径比锂离子半径小 | D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
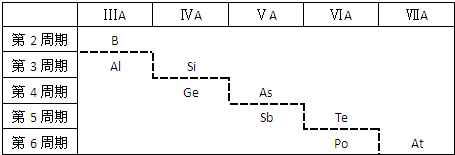
| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 升高温度,反应速率减慢 | |
| B. | 当反应达到化学平衡时,υ(正)=υ(逆)=0 | |
| C. | 提高炼铁高炉的高度可减少尾气中CO的浓度 | |
| D. | 某温度下达到平衡时,CO的体积分数基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
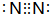 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | NH4+、K+、Al3+、Mg2+ |
| 阴离子 | HCO3-、Cl-、MnO4-、SO42- |
| A. | 肯定没有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com