
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用,它与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:

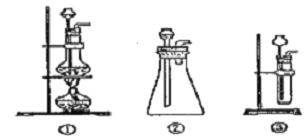
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:___。
B装置的作用是___,C装置内可能出现的现象是___。为了检验E中收集到的气体,在取出集气瓶后,检验方法是___。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:___。(用离子反应方程式表示)。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为260mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值___(答大或小),相差___mL(取整数值,所用数据均在标准状况下测定),这是由于____。
(4)你认为上述A-E的实验装置中,E部分是否安全、合理?___(答是或否),理由是___。
【答案】②、③ 除去CO2中混有的HCl气体 变蓝 向集气瓶中伸入带火星的木条,复燃 Ca2++2OH-+CO2=CaCO3↓+H2O 小 20ml Na2O2没有反应完全 否 E装置没有防倒吸装置,容易引起倒吸
【解析】
(1)实验室用碳酸钙和稀盐酸反应制备二氧化碳,反应无需加热,且反应需要较多二氧化碳,应用图3装置制备;实验中要依次进行除杂、干燥收集等操作;
(2)二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(3)根据过氧化钠的质量可以生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值;
(4)E装置没有防倒吸装置,容易引起倒吸。
(1)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,所以排除图①;图②中能制取少量二氧化碳、图③能制取大量二氧化碳,所以选图②、图③;
大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,所以B装置的作用是吸收A装置中产生的盐酸酸雾,除去CO2中混有的HCl气体;
二氧化碳和碳酸氢钠不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;
过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃,检验时,可用带火星的木条放在管口,木条复燃说明收集到的气体为氧气;
(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致,发生反应Ca2++2OH-+CO2=CaCO3↓+H2O;
(3)1.95g过氧化钠完全反应生成氧气的体积为v.
2Na2O2----O2
2mol 22.4L
![]() V
V
V=0.28L=280mL>260mL,所以实际收集到的氧气体积比理论计算值小;
280mL-260mL=20mL;
原因是Na2O2没有反应完全,导致生成的氧气的体积偏小;
(4)E装置没有防倒吸装置,容易引起倒吸,所以不安全、不合理,所以需要改进。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的______。(填序号)
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
(2)下列可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是______。(填序号)
2HI(g)已达平衡状态的是______。(填序号)
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,容器内气体颜色不再变化
⑨条件一定,混合气体的平均相对分子质量不再变化
(3)已知下列反应的平衡常数:①H2(g)+S(s) ![]() H2S(g),K1;
H2S(g),K1;
②S(s)+O2(g) ![]() SO2(g),K2;则反应H2(g)+SO2(g)
SO2(g),K2;则反应H2(g)+SO2(g) ![]() O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
(4)已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 和
和![]() 以
以![]() (体积比)分别通入到体积为2L的恒容密闭容器中进行反应:
(体积比)分别通入到体积为2L的恒容密闭容器中进行反应:![]() ,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
实验 | 温度/℃ | 起始 | 平衡 | 达平衡所需时间/min |
① | 500 | 5.00 | 2.00 | 40 |
② | 800 | 3.00 | 1.00 | 15 |
③ | 500 | 3.00 | 1.20 | 9 |
A. 实验①中,在![]() 内,以
内,以![]() 表示的反应速率大于
表示的反应速率大于![]()
B. 比较实验①和②,不能说明浓度对反应速率的影响
C. 比较实验①和②,不能说明反应速率随温度升高而增大
D. 比较实验②和③,说明实验③使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某热再生电池工作原理如下图所示。通入![]() 时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。已知电池总反应:
时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。已知电池总反应:![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
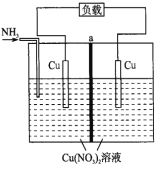
A. 此电池为二次电池
B. 放电时,左边电极发生氧化反应
C. a为阳离子交换膜
D. 放电时,转移![]() 电子,两电极质量变化的差值为
电子,两电极质量变化的差值为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制溴的大致流程如图:

已知溴的沸点为58.7℃,常温下在水中的溶解度为3.58g;溴与碳酸钠溶液反应生成NaBr、NaBrO3、CO2等。则下列理解不正确的是( )
A. 步骤②通热空气是利用了溴的挥发性
B. 从混合液甲到混合液乙,目的是对溴进行富集
C. 步骤④加硫酸后发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为1:1
D. 操作⑤可以采取萃取、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、D、E、F、G均为短周期主族元素,且原子序数依次增大,只有E为金属元素。已知A原子只有一个电子层;E、F的原子序数分别是B、D的2倍,其中D、F同主族,B、E不同主族。回答下列问题:
(1)元素D在周期表中的位置____。
(2)F和G形成的化合物,分子中所有原子均为8电子稳定结构,该化合物的电子式为____。
(3)由上述元素组成的物质中,按下列要求写出化学方程式
①两种弱酸反应生成两种强酸______;
②置换反应,且生成物在常温均为固态____。
(4)在D、F、G中选取2种元素组成具有漂白、杀菌作用的化合物___。
查看答案和解析>>
科目:高中化学 来源: 题型:
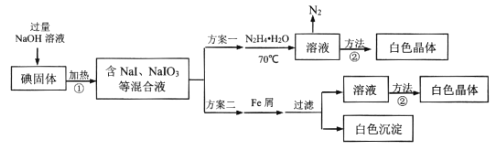
【题目】碘化钠在有机合成中用途广泛,工业制备碘化钠有多种方法,下图是制备碘化钠的两种方案。已知:3I2+6NaOH=5NaI+NaIO3+3H2O;N2H4·H2O的沸点118℃,100℃开始分解。
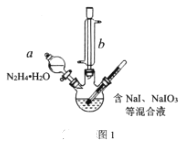
(1)方案一中加入N2H4·H2O后发生的离子反应为:2IO3-(aq)+3N2H4·H2O(l)=2I-(aq)+3N2(g)+7H2O(l) △H<0;部分装置如图1所示。
①图1中仪器b的名称为___。若要使分液漏斗中的液体流入三颈烧瓶中,具体的操作是___。
②实验过程中需控制反应温度70℃左右的原因是___。图1中加热的方式最好选用____。
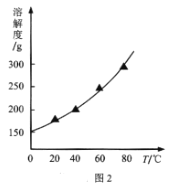
(2)结合NaI溶解度曲线(如图2),流程图中方法②的具体操作为:加热蒸发、___、过滤、洗涤得到白色晶体。
(3)写出方案二中加入Fe屑后的离子方程式_____。
(4)方案二比方案一得到产品的产率略低,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
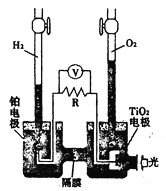
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.TiO2电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉可以除去废液中的NaNO3,发生反应的化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为_____________________________。
(2)该反应的还原剂为___________(填化学式,下同),还原产物为_____________。
(3)2.7g铝粉参与反应,溶液的质量增加_________g。
(4)铝箔表面易形成致密的氧化膜,加热铝箔,铝箔熔化但不滴落,说明____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com