
下列叙述正确的是 ( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.失电子难的原子,获得电子的能力一定强
D.有单质参加或生成的反应一定属于氧化还原反应
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
对某未知有机物进行研究:称取该样品0.352 g,通入足量氧气流充分燃烧,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重0.144g和0.528g,生成物完全被吸收。下列说法错误的是
A.未知物中碳的质量分数是 41% B.未知物中含有C、H、O元素
C.未知物的实验式为C3H4O3 D.已有条件可确定未知物的分子式为C6H8O6
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2 (g) + 3 H2 (g) 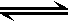 2NH3(g)
2NH3(g)
(1)若反应进行到5min时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a=
(2)用H2的浓度变化表示5min内的平均反应速率为 ;
(3)反应进行到10min时达平衡,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量n(NH3)= 。
(4)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比),n(始)∶n(平) =
II (4分) 将某有机物1.6 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有CaCl2(A)和碱石灰(B)的干燥管,测得A管质量增加了1.8 g,B管质量增加了2.2 g,该有机物蒸汽的密度是同温同压下氢气的16倍。
(1)燃烧此有机物1.6 g需消耗O2多少g? (2)求此有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3―→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是 ( )
A.生成40.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为1.25 mol
D.被还原的N原子的物质的量为3.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3===9Fe(NO3)x+NO↑+14H2O,下列判断合理的是 ( )
A.Fe(NO3)x中的x为2
B.稀HNO3在反应中只表现氧化性
C.反应中每还原0.4 mol氧化剂,就有1.2 mol电子被转移
D.磁性氧化铁中的铁元素全部被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO +Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO +CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②中电子转移的方向和数目:MnO +CuS
+CuS
Ⅱ.在稀硫酸中,MnO 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。由上述反应得出的物质氧化性强弱的结论是________>________(填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )。
A.NH4H是离子化合物
B.NH4H中含有离子键和共价键
C.NH4H与水反应时,NH4H是氧化剂
D.NH4H固体溶于水形成的溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
常用解热镇痛药—扑热息痛的结构简式为 HO—C6H4—NHCOCH3(C6H4表示苯环)。 对它的叙述有:①能与NaHCO3溶液反应;②能发生水解反应;③不能与浓溴水发生取代反应;④遇三氯化铁溶液显紫色。其中正确的是
A. ①和② B.①和④ C.②和③ D.②和④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com