
【题目】金属钨用途广泛,H2还原WO3可得到钨,其总反应为:WO3+3H2![]() W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
W+3H2O,该总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示,假设WO3完全转化为W,则三个阶段消耗H2质量之比为
温度(℃) | 25℃~550℃~600℃~700℃ |
主要成分 | WO3 W2O5 WO2 W |
A.1:1:4B.1:1:3C.1:1:2D.1:1:1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 代替
代替![]() 与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
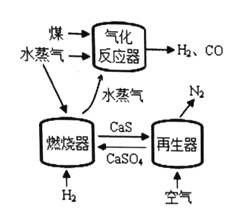
燃烧器中反应①![]() (主反应)
(主反应)
反应②![]() (副反应)
(副反应)
再生器中反应:![]()
(1)气化反应器中发生反应的化学方程式是 ______。
(2)燃烧器中![]() 物质的量分数随温度T、压强p
物质的量分数随温度T、压强p![]() 的变化曲线见图,从图中可以得出三条主要规律:
的变化曲线见图,从图中可以得出三条主要规律:
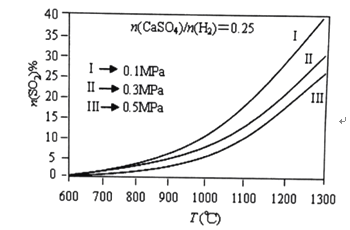
①其他条件不变,温度越高,![]() 含量越高;
含量越高;
②______ ;
③______ ;
由图可知,为减少![]() 的排放量,可采取的措施是 ______。
的排放量,可采取的措施是 ______。
(3)该燃烧技术中可循环的物质除![]() 、CaS外,还有 ______
、CaS外,还有 ______ ![]() 写名称
写名称![]() 。
。
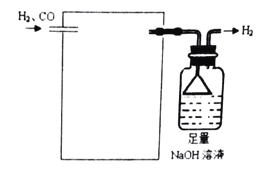
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,完成以下实验装置图:______
中的CO,完成以下实验装置图:______![]() 注:
注:![]() 。
。
(5)CO2在自然界循环时可与![]() 反应,
反应,![]() 是一种难溶物质,其
是一种难溶物质,其![]() 。现将
。现将![]()
![]() 的
的![]() 溶液与一定浓度的
溶液与一定浓度的![]() 溶液等体积混合生成沉淀,计算应加入
溶液等体积混合生成沉淀,计算应加入![]() 溶液的最小浓度为 ______(保留二位有效数字)。
溶液的最小浓度为 ______(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×109]
A. 若将溶液不断加水稀释,则水的电离程度增大
B. 溶液中各离子浓度大小关系:c(Na+)> c(C2O42)> c(OH)> c(H+)> c(HC2O4)
C. 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=105
D. 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×108 mol·L1 时即能产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
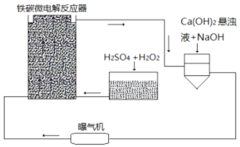
【题目】铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示。
请回答下列问题:
(1)当污水通过铁碳微电解反应器时,会形成数量巨大的微小电池,这些微小电池的负极为______,若污水为酸性溶液,且通过曝气机鼓入充足的空气,正极反应式为:______。
(2)其治理污水原理主要有以下几个方面:
①一些不活泼的重金属离子被Fe置换出来。写出从![]() 中置换金的离子方程式______。
中置换金的离子方程式______。
②在处理过程中,有些胶体会发生电泳,向某极富集,从而聚沉除去。![]() 胶体电泳时,会向______极移动。
胶体电泳时,会向______极移动。
③吸附作用。Fe、C、![]() 、
、![]() 等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
A.都有还原性![]() 表面积都很大
表面积都很大![]() 都含金属元素
都含金属元素![]() 都是胶体
都是胶体
④过程中产生的![]() 能沉淀或结合一些无机阴离子
能沉淀或结合一些无机阴离子![]() 例如
例如![]() 生成FeS沉淀
生成FeS沉淀![]() 。由FeS制备
。由FeS制备![]() 气体可选用______。
气体可选用______。
A.稀硫酸![]() 稀硝酸
稀硝酸![]() 稀盐酸
稀盐酸![]() 浓硫酸
浓硫酸
(3)溶液中的Fe元素最终均转化为![]() 沉淀除去。为更好除去
沉淀除去。为更好除去![]() 和
和![]() ,请参考装置图,从试剂用量角度提出可以采取哪些措施
,请参考装置图,从试剂用量角度提出可以采取哪些措施![]() 回答一条即可
回答一条即可![]() ______。
______。
(4)已知常温下,![]() ;
;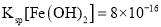 。
。
①计算![]() 的水解常数为______。
的水解常数为______。
②向饱和![]() 、
、![]() 混合溶液中,逐渐加入少量固体
混合溶液中,逐渐加入少量固体![]() 忽略体积和温度变化
忽略体积和温度变化![]() ,
,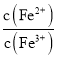 会______,
会______,![]() 选填“逐渐增大”、“逐渐减小”、“不变”
选填“逐渐增大”、“逐渐减小”、“不变”![]() 。结合相关数据推理说明原因______。
。结合相关数据推理说明原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10g碳酸钙高温加热一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%,则下列判断正确的是
A.生成了2g二氧化碳B.剩余固体质量为5g
C.生成了5.6g氧化钙D.剩余碳酸钙的质量为8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,两种不同浓度的NaOH溶液中,c(H+)分别为1×10-14 mol·L-1和1×10-10 mol·L-1。将这两种溶液等体积混合后,所得溶液中c(H+)是
A. 1×(10-14+10-10) mol·L-1 B. ![]()
![]() mol·L-1
mol·L-1
C. 2×10-10 mol·L-1 D. 2×10-14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是

A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol·L-1MCl2溶液中滴加 0.1mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(M2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
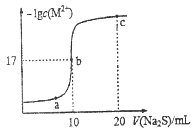
已知:Ksp(NS)=4.0×10-25
A. 该温度下Ksp(MS)=1.0×10-34
B. Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
C. a、b、c三点中,水的电离程度最大的为b点
D. 向NS的悬浊液中加入MCl2溶液,不可能实现NS沉淀转化为MS沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com