
����Ŀ��ʵ���ҴӺ����Һ![]() ����
����![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �л��յ⣬�����������£�
�л��յ⣬�����������£�
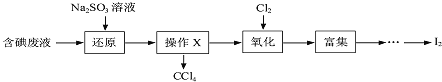
![]() ���Һ�м���
���Һ�м���![]() ��Һ����������ԭ����Ӧ�����ӷ���ʽΪ ______��
��Һ����������ԭ����Ӧ�����ӷ���ʽΪ ______��
![]() ��������������������ƿ�н��У�����Һ���������pHԼΪ2������ͨ��
��������������������ƿ�н��У�����Һ���������pHԼΪ2������ͨ��![]() ��ʵ����ˮԡ������
��ʵ����ˮԡ������![]() ���ҵĽϵ��¶��½��е�ԭ���� ______��
���ҵĽϵ��¶��½��е�ԭ���� ______��
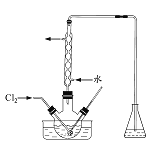
![]() ij�о�С����ͼװ�ö�
ij�о�С����ͼװ�ö�![]() ��KI��Һ�ķ�Ӧ����̽��������ͨ��
��KI��Һ�ķ�Ӧ����̽��������ͨ��![]() һ��ʱ���KI��Һ��Ϊ��ɫ������ͨ��
һ��ʱ���KI��Һ��Ϊ��ɫ������ͨ��![]() ������Һ��ɫ��dz������Ϊ��ɫ���о�С���������ɫ��Һ�е�Ԫ�صĴ�����̬��������¼��裺
������Һ��ɫ��dz������Ϊ��ɫ���о�С���������ɫ��Һ�е�Ԫ�صĴ�����̬��������¼��裺
����һ��û��![]() ��̬���������û��
��̬���������û��![]() ��̬������������
��̬������������![]() ��̬��
��̬��
![]() �����ʵ��֤������һ����
�����ʵ��֤������һ����![]() �Լ���ѡ
�Լ���ѡ![]() ��
��
ʵ����� | Ԥ������ | ���� |
_______ | _______ | ����һ���� |
![]() ���������������������
����������������д������![]() �����ӷ���ʽ ______��
�����ӷ���ʽ ______��
![]() ���о�С�黹�����˶Լӵ�����
���о�С�黹�����˶Լӵ�����![]() �����ⶨ������ʵ�飺
�����ⶨ������ʵ�飺
![]() ȷ��ȡ�ӵ���mg���ձ��У�������������ˮ������KI���ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���
ȷ��ȡ�ӵ���mg���ձ��У�������������ˮ������KI���ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���![]() ������Һ����ȡ
������Һ����ȡ![]() ������Һ����ƿ�У��Ӽ��ε�����Һ����c
������Һ����ƿ�У��Ӽ��ε�����Һ����c![]()
![]() ��Һ�ζ����յ㣬�ظ�3�Σ����ƽ��ֵΪVmL��
��Һ�ζ����յ㣬�ظ�3�Σ����ƽ��ֵΪVmL��
��֪��![]() ��
��![]() ���ⶨʱ���жϴﵽ�ζ��յ������Ϊ ______ ���ɲⶨ���ݿ���ø���Ʒ�к�
���ⶨʱ���жϴﵽ�ζ��յ������Ϊ ______ ���ɲⶨ���ݿ���ø���Ʒ�к�![]() ����������Ϊ ______
����������Ϊ ______ ![]() �ú�m��c��V�Ĵ���ʽ��ʾ��
�ú�m��c��V�Ĵ���ʽ��ʾ��![]()
![]() ��
��
![]() �ڵζ�������ȷ���������£��ô��ֲⶨ������õĽ������ƫ�ߣ���ԭ�����ܿ�����Ӱ�죬�������ӷ���ʽ��ʾ������һӰ���ԭ�� ______��
�ڵζ�������ȷ���������£��ô��ֲⶨ������õĽ������ƫ�ߣ���ԭ�����ܿ�����Ӱ�죬�������ӷ���ʽ��ʾ������һӰ���ԭ�� ______��
���𰸡�![]() ʹ��������Һ���нϴ���ܽ��
ʹ��������Һ���нϴ���ܽ��![]() ���ֹ
���ֹ![]() �������ֹ
�������ֹ![]() ��һ��������
��һ��������![]()
![]() ȡ������ɫ��Һ�������м��������Һ ��Һ������ ��Һ����ɫ��Ϊ��ɫ���Ұ���Ӳ���ɫ
ȡ������ɫ��Һ�������м��������Һ ��Һ������ ��Һ����ɫ��Ϊ��ɫ���Ұ���Ӳ���ɫ ![]()
![]()
��������
![]() ����������Ӿ���ǿ�Ļ�ԭ���ܹ���ԭ���ʵ⣻
����������Ӿ���ǿ�Ļ�ԭ���ܹ���ԭ���ʵ⣻
![]() �¶�Խ�ߣ������ܽ��ԽС��
�¶�Խ�ߣ������ܽ��ԽС��
![]() �����������۱���ɫ��
�����������۱���ɫ��
![]() �����ɵ�������ӣ���������������ķ�Ӧ�����ݵ�ʧ�����غ㡢ԭ�Ӹ����غ�д����Ӧ����ʽ��
�����ɵ�������ӣ���������������ķ�Ӧ�����ݵ�ʧ�����غ㡢ԭ�Ӹ����غ�д����Ӧ����ʽ��
![]() ��Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Һ��ʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㣻
��Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Һ��ʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㣻
���ݹ�ϵʽ![]() ���м��㣻
���м��㣻
![]() ʵ���ý��ƫ�ߣ�˵���ζ����ĵ�
ʵ���ý��ƫ�ߣ�˵���ζ����ĵ�![]() ��Һ���ƫ�ߣ���Һ�е�ĺ���ƫ�ߣ�Ӧ�����ɵĵ����ӱ���������Ϊ�����¡�
��Һ���ƫ�ߣ���Һ�е�ĺ���ƫ�ߣ�Ӧ�����ɵĵ����ӱ���������Ϊ�����¡�
![]() �������������ⷢ��������ԭ��Ӧ�����ӷ���ʽ��
�������������ⷢ��������ԭ��Ӧ�����ӷ���ʽ��![]() ��
��
![]() �¶�Խ�ߣ������ܽ��ԽС��Ϊ���������ܽ������Ӧ�����ڵ��������£�
�¶�Խ�ߣ������ܽ��ԽС��Ϊ���������ܽ������Ӧ�����ڵ��������£�
![]() �ⵥ���������۱���ɫ��������������ɫ��Һ�м��������Һ����������ɫ��˵�������ڵ⣻
�ⵥ���������۱���ɫ��������������ɫ��Һ�м��������Һ����������ɫ��˵�������ڵ⣻
�ʴ�Ϊ��
ʵ����� | Ԥ������ |
ȡ������ɫ��Һ�������м��������Һ | ��Һ������ |
![]() �������������������������ⵥ�����ɵ�������ӣ���������ԭΪ�����ӣ����ݵ�ʧ�����غ���ɡ�ԭ�Ӹ����غ���ɣ��÷�Ӧ�����ӷ���ʽ��
�������������������������ⵥ�����ɵ�������ӣ���������ԭΪ�����ӣ����ݵ�ʧ�����غ���ɡ�ԭ�Ӹ����غ���ɣ��÷�Ӧ�����ӷ���ʽ��![]() ��
��
![]() �������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��
�������۱���ɫ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��![]() ��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㣻
��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㣻
����Ʒ��![]() ����������Ϊa����
����������Ϊa����
![]()
214 6
ma![]() ��
��
��ã�![]() ��
��
![]() ʵ���ý��ƫ�ߣ�˵���ζ����ĵ�
ʵ���ý��ƫ�ߣ�˵���ζ����ĵ�![]() ��Һ���ƫ�ߣ���Һ�е�ĺ���ƫ�ߣ�Ӧ�����ɵĵ����ӱ���������Ϊ�⣬ͬʱ����ˮ����Ӧ���ӷ���ʽΪ
��Һ���ƫ�ߣ���Һ�е�ĺ���ƫ�ߣ�Ӧ�����ɵĵ����ӱ���������Ϊ�⣬ͬʱ����ˮ����Ӧ���ӷ���ʽΪ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨Ƭ�ϼ�¼���£�������ȷ���ǣ� ��
��Zn������Cu������
��H+���ƶ���
�۵�������Zn�����·����Cu��
��Cu������H2������
������1mol�����������ߣ��������H2Ϊ0.5mol��
�������ĵ缫��ӦʽΪZn��2e���TZn2+��
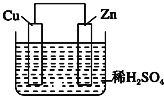
A���٢ڢ� B���ۢܢ� C���ܢݢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п������õİ�ͷ���������� H �ĺϳ�·������ͼ��ʾ��
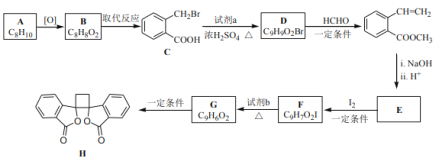
��֪��i��RCH2Br![]() R��HC=CH��R��
R��HC=CH��R��
ii��R��HC=CH��R��![]()
![]()
iii��R��HC=CH��R��![]()
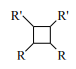 (����R��R����R�������⡢�����)
(����R��R����R�������⡢�����)
(1)A ���ڷ���������������_____________��
(2)B �Ľṹ��ʽ��___________________��
(3)�� C ���� D �Ļ�ѧ����ʽ��___________________��
(4)�� E �� I2 ��һ�������·�Ӧ���� F �Ļ�ѧ����ʽ��_____________���˷�Ӧͬʱ��������һ���л����������� F ��Ϊͬ���칹�壬���л�������Ľṹ��ʽ��_________________��
(5)�Լ� b ��__________________��
(6)����˵����ȷ����______________(ѡ����ĸ���)��
a��G ����˳���칹��
b���� G ���� H �ķ�Ӧ�Ǽӳɷ�Ӧ
c��1 mol G �������� 1 mol H2 �����ӳɷ�Ӧ
d��1 mol F �� 1 mol H ������ NaOH ��Һ��Ӧ�������� 2 molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
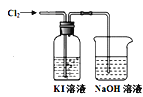
����Ŀ��Ϊ̽��Fe3+��Cu2+��H2O2�ֽⷴӦ�Ĵ�Ч����ijͬѧ�ֱ������ͼ1��ͼ2��ʾ��ʵ�顣���������в���ȷ����

A.ͼ2�е�AΪ��Һ©��
B.ͼ2ʵ���ͨ���ⶨ��ͬ״���²�������������뷴Ӧʱ�����ȽϷ�Ӧ����
C.ͼ1ʵ���ͨ���۲�������ݵĿ������ȽϷ�Ӧ����
D.��ͼ1ʵ���з�Ӧ����Ϊ�٣��ڣ���Fe3+��H2O2�ֽ�Ĵ�Ч��һ����Cu2+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A~H���ֶ���������Ԫ�������ڱ��е����λ����ͼ��ʾ����֪CԪ���γɵĵ�������������������������![]() ������ϼ�����ͻ��ϼ�֮��Ϊ2���ش��������⣺
������ϼ�����ͻ��ϼ�֮��Ϊ2���ش��������⣺
A | ���� | D | E | F | ||
B | C | ���� | G | H |
(1)DԪ�������ڱ��е�λ��Ϊ________________��
(2)����Ԫ�����γɵ���̬����������������ˮ��������________________(�ѧʽ)��
(3)B�ĵ�����F�ĵ�����ȼ�յĻ�����ɫΪ________��
(4)CԪ�صĵ��ʿ�����D��F�γɵ�һ����̬��������ȼ�գ�д���÷�Ӧ�Ļ�ѧ����ʽ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�飺��0.005mol��L-1FeCl3��Һ��0.015mol��L-1KSCN��Һ��1mL��ϵõ���ɫ��Һa��������Һa����b��c��֧�Թ��У�
����b�еμ�3�α���FeCl3��Һ����Һ��ɫ���
����������b��Һ�еμ�3��1mol��L-1NaOH��Һ����Һ��ɫ��dz�ҳ��ֻ��ǣ�
����c���μ�1mol��L-1KSCN��Һ2mL����Һ��ɫ�ȱ�����dz�����з�������ȷ���ǣ� ��
A.ʵ���������Fe3+Ũ��ʹƽ��Fe3++3SCN-![]() Fe(SCN)3�����ƶ�
Fe(SCN)3�����ƶ�
B.ʵ�������Fe(OH)3����
C.ʵ��ۺ͢�����Һ��ɫ��dz��ԭ����ͬ
D.ʵ��ڡ��ۡ��ܾ���˵��Ũ�ȸı��ƽ���ƶ���Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҳ�����ͼ��ʾװ���Ʊ�����������ʵ�������ȡ��ʢ�б���̼������Һ���Թܣ����ظ��Թ��ڱڻ�������ʯ����Һ1����������ʯ����Һ�����ڱ���̼������Һ������������Һ��֮��(�������̲����Թ�)�������йظ�ʵ�����������ȷ����( )
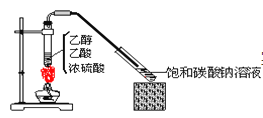
A.�Ʊ������������л���������Ҵ�����
B.��ʵ����Ũ����������Ǵ�����ˮ
C.����̼������Һ��Ҫ�����ǽ��������������ܽ�ȼ������Ҵ�������
D.ʯ���Ϊ���㣬���϶����������ϡ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3����ԭNO����Ҫ�����������������䷴Ӧ������������ϵ��ͼ���о���������Fe2O3Ϊ���Ĵ����Ͽ��ܷ����ķ�Ӧ������ͼ������˵����ȷ���� ���� ��
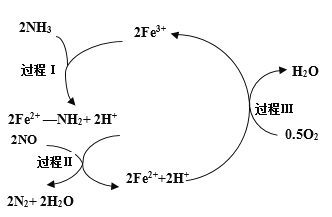
A.NH3����ԭNOΪ���ȷ�Ӧ
B.���̢���NH3���ѷǼ��Լ�
C.���̢���NOΪ��������Fe2+Ϊ��ԭ��
D.�������ܷ�ӦΪ�� 4NH3(g)+4NO(g)+ O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����0.1 mol Fe(NO3)3��2 mol HCl����ˮ�õ�2L�����Һ��Ȼ�������Һ��Ͷ��m g���ۣ���ַ�Ӧ�μ�KSCN��Һ�����ɫ�������й�˵����ȷ����
A.���������ԣ�Fe3+>H+�������ȷ����ķ�Ӧ��Fe+2Fe3+=3Fe2+
B.��ַ�Ӧ������56 g��
C.m=28ʱ����Һʣ��0.9 mol H+
D.������16.8 g����ʱ�������ɱ�״����6.72 L����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com