
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1。下列叙述不正确的是( )
A.反应中共消耗1.8 mol H2SO4
B.气体甲中SO2与H2的体积比为4∶1
C.反应中共消耗97.5 g Zn
D.反应中共转移1.5 mol电子
答案 BD
解析 反应后溶液的pH=1,说明硫酸过量,且反应后硫酸的物质的量为0.05 mol,则反应掉的硫酸的物质的量为18.5×0.1 mol-0.05 mol=1.8 mol,A正确;随着反应的进行,硫酸浓度会变稀,可能会生成氢气,所以生成的气体甲可能是SO2和H2的混合物,由Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)===ZnSO4+H2↑,不论是生成SO2还是H2都是1 mol Zn产生1 mol气体甲,n(Zn)=n(甲)=n(ZnSO4)=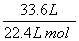 =1.5 mol,则反应中共消耗Zn 97.5 g,C正确;反应中转移电子的物质的量为锌的物质的量的两倍,为3 mol,D错误;由硫原子守恒可知n(SO2)=1.8 mol-1.5 mol=0.3 mol,n(H2)=1.5 mol-0.3 mol=1.2 mol,所以SO2和H2的体积比为1∶4,B错误。
=1.5 mol,则反应中共消耗Zn 97.5 g,C正确;反应中转移电子的物质的量为锌的物质的量的两倍,为3 mol,D错误;由硫原子守恒可知n(SO2)=1.8 mol-1.5 mol=0.3 mol,n(H2)=1.5 mol-0.3 mol=1.2 mol,所以SO2和H2的体积比为1∶4,B错误。


科目:高中化学 来源: 题型:
如果取一块冰放在容器里,不断地升高温度,可以实现“冰→水→水蒸气→氢气和氧气”的变化,在各步变化时破坏的粒子间的相互作用力依次是( )
A.氢键、极性键、非极性键
B.氢键、氢键、极性键
C.氢键、氢键、非极性键
D.氢键、非极性键、极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题。
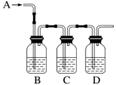
(1)B中加入的试剂是________,作用是______________________________________________。
(2)C中加入的试剂是__________,作用是__________________________________________。
(3)D中加入的试剂是________,作用是___________________________________________。
(4)实验时,C中应观察到的现象是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关硫元素及其化合物的说法或描述正确的是( )
A.硫黄矿制备硫酸经历两步:S SO3
SO3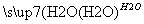 H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2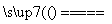 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)34S原子核内中子数为16( )
(2)2H+核外电子数为2( )
(3)1H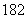 O的摩尔质量为20 g·mol-1( )
O的摩尔质量为20 g·mol-1( )
(4)13C和15N核内中子数相差1( )
(5)H3O+和OH-中具有相同的质子数和电子数( )
(6)O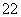 和S2-具有相同的质子数和电子数( )
和S2-具有相同的质子数和电子数( )
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空(均为短周期元素)
(1)最外层电子数为1的元素有______(填元素符号,下同)。
(2)最外层电子数为2的元素有______。
(3)最外层电子数与次外层电子数相等的元素有______。
(4)最外层电子数是次外层电子数2倍的元素是______。
(5)最外层电子数是次外层电子数3倍的元素是______。
(6)次外层电子数是最外层电子数2倍的元素有______。
(7)内层电子总数是最外层电子数2倍的元素有______。
(8)电子层数与最外层电子数相等的元素有______。
(9)最外层电子数是电子层数2倍的元素有______。
(10)最外层电子数是电子层数3倍的元素有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
制备氮化镁的装置示意图如下:

回答下列问题:
(1)检查装置气密性的方法是____________,a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式_____________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________________________________________________________________________。
(4)写出E中发生反应的化学方程式
________________________________________________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com