
分析 (1)根据盖斯定律结合热化学方程式计算所需热化学方程式;
(2)利用化学平衡三行式解答,设平衡时CO转化x mol•L-1;
2H2(g)+CO(g)?CH3OH(l)
起始时各物质浓度(mol•L-1 ) 1.5 1 0
变化浓度(mol/L) 2x x x
平衡时各物质浓度(mol•L-1 ) 1.5-2x 1-x x
依题意有达到平衡时,测得容器内的压强是反应前压强的$\frac{3}{5}$,
1.5-2x+1-x+x=$\frac{3}{5}$×2.5
x=0.5,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(3)利用Q与K的关系判断,Q=K,达到平衡,Q>K向逆向进行,Q<K向正向进行.
解答 解:(1)根据盖斯定律:①-②×$\frac{1}{2}$得CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:2H2(g)+CO(g)=CH3OH(l)△H =+131.9 kJ/mol;
故答案为:2H2(g)+CO(g)=CH3OH(l)△H =+131.9 kJ/mol;
(2)设平衡时CO转化x mol•L-1;
2H2(g)+CO(g)?CH3OH(l)
起始时各物质浓度(mol•L-1 ) 1.5 1 0
变化浓度(mol/L) 2x x x
平衡时各物质浓度(mol•L-1 ) 1.5-2x 1-x x
依题意有达到平衡时,测得容器内的压强是反应前压强的$\frac{3}{5}$,
1.5-2x+1-x+x=$\frac{3}{5}$×2.5
x=0.5
平衡常数K=$\frac{x}{(1.5-x)^{2}(1-x)}$=$\frac{0.5}{0.{5}^{2}×0.5}$=4
答:该温度下反应的平衡常数为4;
(3)该反应的平衡常数表达式为:K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})c(CO)}$,在恒温恒容的条件下,向(2)达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则Q=$\frac{2c(C{H}_{3}OH)}{2c(CO){c}^{2}({H}_{2})}$=K,平衡不移动,选C.
故答案为:C.
点评 本题考查了化学平衡计算应用,主要是平衡常数、转化率的计算,平衡移动原理和平衡影响因素分析是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
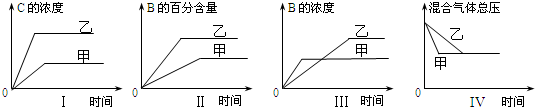
| A. | 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 | |
| B. | 图Ⅱ研究的是压强对反应的影响,且乙的压强较高 | |
| C. | 图Ⅲ研究的是温度对反应的影响,且甲的温度较高 | |
| D. | 图IV 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 C2H6 | B. | CH4 C3H8 | C. | C3H6 C3H8 | D. | C2H4 C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:NH3>PH3>H2S | ||
| C. | 酸性:HClO4>H2SiO3>H3PO4 | D. | 元素非金属性:F>O>N |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在新装修的室内摆放适宜的花卉--改善室内空气质量 | |
| B. | 限制生产、使用含磷洗涤剂--防止出现“臭氧空洞” | |
| C. | 严禁排放未经处理的有毒工业废水--防止水土流失 | |
| D. | 给汽车安装尾气净化装置--减少氮的氧化物及一氧化碳的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与D形成的单质分别为甲、乙,非金属性:B>D,活泼性:乙>甲 | |
| B. | 1mol E2C2与足量水完全反应生成C的单质,共转移2mol电子 | |
| C. | 原子半径:D>E>A>B>C | |
| D. | C的最简单氢化物的沸点比B的最简单氢化物的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 着色剂--苯甲酸钠 | B. | 调味剂--亚硝酸钠 | ||
| C. | 营养强化剂--粮食制品中加赖氨酸 | D. | 防腐剂--苋菜红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,消去反应
,消去反应 ,取代反应
,取代反应 ,取代反应.
,取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com