
| A. | 元素周期律的实质是元素原子的核外电子排布呈周期性变化 | |
| B. | 利用元素周期律可以预测元素及其化合物的性质 | |
| C. | 元素周期表有7个横行,也就是7个周期 | |
| D. | 元素周期表有18个纵列,也就是18个族 |
分析 元素周期表有7个周期、6个族,元素的性质随原子的电子排布呈现周期表的变化,利用元素周期表和周期律可预测元素的性质,以此来解答.
解答 解:A.元素性质的周期性变化由原子结构的周期性变化引起,则元素周期律的实质是元素原子的核外电子排布呈周期性变化,故A正确;
B.同周期、同主族元素的性质具有递变规律,则利用元素周期律可以预测元素及其化合物的性质,故B正确;
C.元素周期表横行数=周期数,则有7个横行,也就是7个周期,故C正确;
D.元素周期表有18个纵列,含16个族,7个主族、7个副族、1个0族、1个第ⅤⅢ族,周期表中8、9、10三个纵行为第ⅤⅢ族,故D错误;
故选D.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素周期表的结构及应用、元素性质的变化规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | B. | 离子浓度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 电离常数:K(HZ)>K(HY) | D. | HX、HY、HZ的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金 | B. | 复合材料 | C. | 纯净物 | D. | 有机材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| B. | CO2通入水玻璃中可得硅酸 | |
| C. | 因高温时,SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | 石英是制造玻璃的主要原料之一,它在常温下不与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 分解反应都是吸热反应,化合反应都是放热反应 | |
| C. | 若反应放热,则反应物的总能量大于生成物的总能量 | |
| D. | 利用化学反应可以合成自然界中不存在的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可以利用如图所示装置制备氯气.
实验室可以利用如图所示装置制备氯气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
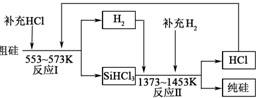 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.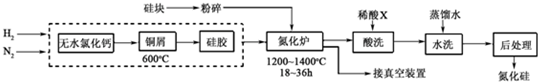
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com