

 .
. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. .
.分析 由题中各物质的转化关系可知,CH3CH2CH2Br在氢氧化钠乙醇溶液中发生消去反应生成A为CH3CH=CH2,CH3CH=CH2在NBS作用之下发生取代反应生成B为BrCH2CH=CH2,BrCH2CH=CH2与Br2生成C为BrCH2CHBrCH2Br,BrCH2CHBrCH2Br再碱性水解(取代反应)生成D为HOCH2CH(OH)CH2OH,根据 可知,I应为
可知,I应为 ,根据E与氯气在光照条件下发生取代反应生成F,F发生碱性水解得G,G发生氧化反应得H,H氧化得再酸化得I,可以推知H为
,根据E与氯气在光照条件下发生取代反应生成F,F发生碱性水解得G,G发生氧化反应得H,H氧化得再酸化得I,可以推知H为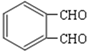 ,G为
,G为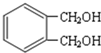 ,F为
,F为 ,E为
,E为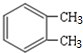 ,据此答题.
,据此答题.
解答 解:由题中各物质的转化关系可知,CH3CH2CH2Br在氢氧化钠乙醇溶液中发生消去反应生成A为CH3CH=CH2,CH3CH=CH2在NBS作用之下发生取代反应生成B为BrCH2CH=CH2,BrCH2CH=CH2与Br2生成C为BrCH2CHBrCH2Br,BrCH2CHBrCH2Br再碱性水解(取代反应)生成D为HOCH2CH(OH)CH2OH,根据 可知,I应为
可知,I应为 ,根据E与氯气在光照条件下发生取代反应生成F,F发生碱性水解得G,G发生氧化反应得H,H氧化得再酸化得I,可以推知H为
,根据E与氯气在光照条件下发生取代反应生成F,F发生碱性水解得G,G发生氧化反应得H,H氧化得再酸化得I,可以推知H为 ,G为
,G为 ,F为
,F为 ,E为
,E为 ,
,
(1)根据上面的分析可知,F的结构简式为 ,
,
故答案为: ;
;
(2)根据上面的分析可知,B的结构简式为BrCH2CH=CH2,
故答案为:BrCH2CH=CH2;
(3)根据上面的分析可知,反应①~③中属于取代反应的是②③,
故答案为:②③;
(4)反应⑤的化学方程式是HOCH2CH(OH)CH2OH+ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,
+H2O,
故答案为:HOCH2CH(OH)CH2OH+ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;
+H2O;
(5)a.B为BrCH2CH=CH2,B不存在顺反异构,故a错误;
b.H为 ,1mol H与足量的银氨溶液反应能生成4mol Ag,故b错误;
,1mol H与足量的银氨溶液反应能生成4mol Ag,故b错误;
c.I应为 ,I能与NaHCO3反应产生CO2,故c正确;
,I能与NaHCO3反应产生CO2,故c正确;
d.D为HOCH2CH(OH)CH2OH,丁烷、1-丙醇和D中沸点最高的为HOCH2CH(OH)CH2OH,故d错误;
故选c;
(6)G为 ,根据条件a.能与浓溴水反应生成白色沉淀,说明有酚羟基,b.苯环上一氯代物有两种,c.能发生消去反应,说明羟基邻位碳上有氢原子,则符合条件的与G 互为同分异构体的结构简式为
,根据条件a.能与浓溴水反应生成白色沉淀,说明有酚羟基,b.苯环上一氯代物有两种,c.能发生消去反应,说明羟基邻位碳上有氢原子,则符合条件的与G 互为同分异构体的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,需要学生对给予的信息进行利用,能较好的考查学生自学能力与迁移运用能力,注意根据转化关系中的物质结构与反应条件进行推断,熟练掌握官能团的性质,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电器着火,立即用水烧灭 | B. | 煤气泄漏,立即开灯查看 | ||
| C. | 房间着火,立即开窗通风 | D. | 油锅着火,立即盖上锅盖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁元素在反应①中被氧化,在③中被还原 | |
| B. | 反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 | |
| C. | 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+ | |
| D. | 还原性强弱顺序为:I->Fe2+>Br->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀时,通常把待镀的金属制品作阳极 | |
| B. | 氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 | |
| C. | 氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-═2H2O | |
| D. | 工业冶炼金属铝的方法是电解熔融的氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中 | |
| B. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| C. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| D. | 用萃取的方法分离汽油和煤油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com