
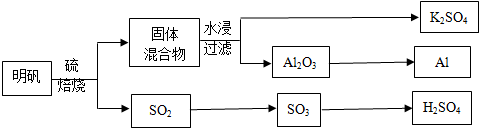

·ÖĪö £Ø1£©ŅĄ¾Ż»Æѧ·½³ĢŹ½ÖŠŌŖĖŲ»ÆŗĻ¼Ū±ä»Æ·ÖĪöÅŠ¶Ļ£¬ŌŖĖŲ»ÆŗĻ¼ŪÉżøßµÄ×ö»¹Ō¼Į·¢ÉśŃõ»Æ·“Ó¦£»
£Ø2£©ÓƵē½āČŪČŚµÄČżŃõ»Æ¶žĀĮÖʵĆĀĮ£»
£Ø3£©¢ŁÓÉĶ¼æÉÖŖ£¬S£Øs£©+O2£Øg£©=SO2£Øg£©”÷H=-297.0kJ/mol£¬SO2£Øg£©+$\frac{1}{2}$O2£Øg£©=SO3£Øg£©”÷H=-98.7kJ/mol£¬½įŗĻøĒĖ¹¶ØĀÉ·ÖĪö£»
¢ŚSO2×Ŗ»ÆĪŖSO3µÄ»Æѧ·½³ĢŹ½2SO2+O2$?_{”÷}^{“߻ƼĮ}$2SO3£»
¢Ūµ±·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ø÷ĪļÖŹµÄÅØ¶Č”¢°Ł·Öŗ¬Įæ²»±ä£¬ŅŌ¼°ÓÉ“ĖŃÜÉśµÄŅ»Š©ĮæŅ²²»·¢Éś±ä»Æ£¬×¢ŅāŃ”ŌńµÄĪļĄķĮæÓ¦Ėę·“Ó¦·¢Éś±ä»Æ£¬øĆĪļĄķĮæÓɱä»Æµ½²»±ä»Æ£¬ĖµĆ÷µ½“ļĘ½ŗā£»
¢Üøł¾Ż»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½K=$\frac{c{\;}^{2}£ØSO{\;}_{3}£©}{c{\;}^{2}£ØSO{\;}_{2}£©•c£ØO{\;}_{2}£©}$¼ĘĖć£»
£Ø4£©·ÅµēŹ±NiO£ØOH£©×Ŗ»ÆĪŖNi£ØOH£©2£¬NiŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬±»»¹Ō£¬Ó¦ĪŖŌµē³ŲÕż¼«·“Ó¦£»
£Ø5£©øł¾ŻĮņŌ×ÓŹŲŗć½ųŠŠ¼ĘĖć£»
½ā“š ½ā£»£Ø1£©4KAl£ØSO4£©2•12H2O+3SØT2K2SO4+2Al2O3+9SO2+48H2O·“Ó¦Įņµ„ÖŹÖŠĮņŌŖĖŲ»ÆŗĻ¼ŪÉżøßĪŖ+4¼Ū£®ĮņĖįøłĄė×ÓÖŠĮņŌŖĖŲ»ÆŗĻ¼Ū“Ó+6¼Ū±ä»ÆĪŖ+4¼Ū£¬ø“Ó”Ö½»¹Ō¼ĮŹĒĮņµ„ÖŹ£»
¹Ź“š°øĪŖ£ŗS£»
£Ø2£©ÓƵē½āČŪČŚµÄČżŃõ»Æ¶žĀĮÖʵĆĀĮ£¬·½³ĢŹ½ĪŖ£ŗ2Al2O3$\frac{\underline{\;Ķصē\;}}{\;}$4Al+3O2”ü£¬¹Ź“š°øĪŖ£ŗ2Al2O3$\frac{\underline{\;Ķصē\;}}{\;}$4Al+3O2”ü£»
£Ø3£©¢ŁÓÉĶ¼æÉÖŖ£¬S£Øs£©+O2£Øg£©=SO2£Øg£©”÷H=-297.0kJ/mol£¬SO2£Øg£©+$\frac{1}{2}$O2£Øg£©=SO3£Øg£©”÷H=-98.7kJ/mol£¬
ÓÉøĒĖ¹¶ØĀÉæÉÖŖ£¬Į½øö·“Ó¦Ļą¼ÓæɵĆS£Øs£©+$\frac{3}{2}$O2£Øg£©=SO3£Øg£©”÷H=-297.0kJ/mol+£Ø-98.7kJ/mol£©=-395.7kJ/mol£¬
¹Ź“š°øĪŖ£ŗS£Øs£©+$\frac{3}{2}$O2£Øg£©=SO3£Øg£©”÷H=-395.7kJ/mol£»
¢ŚSO2×Ŗ»ÆĪŖSO3µÄ»Æѧ·½³ĢŹ½2SO2+O2$?_{”÷}^{“߻ƼĮ}$2SO3£»¹Ź“š°øĪŖ£ŗ2SO2+O2$?_{”÷}^{“߻ƼĮ}$2SO3£»
¢Ūa£®ČŻĘ÷ÖŠc£ØSO2£©=c£ØSO3£©£¬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źa“ķĪó£»
b£®Éś³É1molO2µÄĶ¬Ź±£¬Éś³É2molSO3£¬ŌņÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹbÕżČ·£»
c£®øĆ·“Ó¦ĪŖŃ¹Ēæ¼õŠ”µÄ·“Ó¦£¬ŌņČŻĘ÷ÖŠĢåĻµµÄ×ÜŃ¹Ēæ²»Ėꏱ¼ä¶ų±ä»Æ£¬ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źc“ķĪó£»
d£®ČŻĘ÷µÄČŻ»ż²»±ä£¬»ģŗĻĘųĢåµÄ×ÜÖŹĮæ²»±ä£¬»ģŗĻĘųĢåĆܶȏ¼ÖÕ²»±ä£¬ĆÜ¶Č²»Ėꏱ¼ä¶ų±ä»Æ£¬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źd“ķĪó£¬
¹ŹŃ”bc£»
¢Üøł¾Ż·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½£ŗ
2SO2£Øg£©+O2 £Øg£©?2SO3£Øg£©£¬
æŖŹ¼0.4 0.24 0
×Ŗ»Æ0.4”Į80%=0.32 0.16 0.32
Ę½ŗā0.08 0.08 0.32
“ļµ½Ę½ŗāŹ±ø÷×é·ÖµÄÅضČĪŖ£ŗc£ØSO2£©=$\frac{0.08mol}{2L}$=0.04mol/L£¬c£ØO2£©=0.04mol/L£¬c£ØSO3£©=$\frac{0.32mol}{2L}$=0.16mol/L£¬
øĆĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżK=$\frac{c{\;}^{2}£ØSO{\;}_{3}£©}{c{\;}^{2}£ØSO{\;}_{2}£©•c£ØO{\;}_{2}£©}$=$\frac{0.16{\;}^{2}}{0.04{\;}^{2}”Į0.04}$=400£¬¹Ź“š°øĪŖ£ŗ400£»
£Ø4£©·ÅµēŹ±NiO£ØOH£©×Ŗ»ÆĪŖNi£ØOH£©2£¬NiŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬±»»¹Ō£¬Ó¦ĪŖŌµē³ŲÕż¼«·“Ó¦£¬µē¼«·½³ĢŹ½ĪŖNiO£ØOH£©+H2O+e-ØTNi£ØOH£©2+OH-£¬
¹Ź“š°øĪŖ£ŗNiO£ØOH£©+H2O+e-ØTNi£ØOH£©2+OH-£»
£Ø5£©Ć÷·ÆµÄĪļÖŹµÄĮæ=$\frac{948”Į10{\;}^{6}g}{474g/mol}$=2”Į106mol£¬øł¾Ż·½³ĢŹ½ÖŖ£¬Éś³É¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæ=$\frac{2”Į10{\;}^{6}mol}{4}$=4.5”Į106mol£¬SO2µÄĄūÓĆĀŹĪŖ96%£¬øł¾ŻĮņŌ×ÓŹŲŗćÖŖ£¬ĮņĖįµÄĪļÖŹµÄĮæ=¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæ=4.32”Į106mol£¬Ōņ98%µÄÖŹĮæ=$\frac{4.32”Į10{\;}^{6}mol”Į98g/mol}{98%}$=4.32”Į106g=432¶Ö£¬¹Ź“š°øĪŖ£ŗ432£®
µćĘĄ ±¾Ģāæ¼²éĮĖŃõ»Æ»¹Ō·“Ó¦µÄ·ÖĪö£¬øĒĖ¹¶ØĀɵļĘĖć£¬»ÆŃ§Ę½ŗāµÄ¼ĘĖćŅŌ¼°µē¼«·½³ĢŹ½µÄŹéŠ“µČ£¬ĢāÄæÄѶČÖŠµČ£¬ŹŌĢāÓŠĄūÓŚÅąŃųѧɜµÄĀß¼ĶĘĄķÄÜĮ¦£¬ĢįøßѧɜĮé»īŌĖÓĆ»ł“”ÖŖŹ¶½ā¾öŹµ¼ŹĪŹĢāµÄÄÜĮ¦¼°»Æѧ¼ĘĖćÄÜĮ¦£®


 ÓÅŅķŠ”°ļŹÖĶ¬²½æŚĖćĻµĮŠ“š°ø
ÓÅŅķŠ”°ļŹÖĶ¬²½æŚĖćĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 īŃŗĶīѵÄŗĻ½šŅѱ»¹ć·ŗÓĆÓŚÖĘŌģµēѶĘ÷²Ä”¢ČĖŌģ¹Ē÷Ą”¢»Æ¹¤Éč±ø”¢·É»śµČŗ½Ģģŗ½æÕ²ÄĮĻ£¬±»ÓžĪŖ”°Ī“Ą“ŹĄ½ēµÄ½šŹō”±£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
īŃŗĶīѵÄŗĻ½šŅѱ»¹ć·ŗÓĆÓŚÖĘŌģµēѶĘ÷²Ä”¢ČĖŌģ¹Ē÷Ą”¢»Æ¹¤Éč±ø”¢·É»śµČŗ½Ģģŗ½æÕ²ÄĮĻ£¬±»ÓžĪŖ”°Ī“Ą“ŹĄ½ēµÄ½šŹō”±£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Cu2+”¢Br-”¢HCO3-”¢AlO2- | B£® | Fe3+”¢K+”¢SCN-”¢SO42- | ||
| C£® | Fe2+”¢NO3-”¢HSO3-”¢Ag+ | D£® | Na+”¢AlO2-”¢K+”¢C6H5O- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼×Ķé | B£® | ŅŅĶé | C£® | ŅŅĻ© | D£® | ±½ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
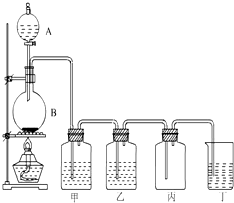 ČēĶ¼ĪŖŹµŃéŹŅÖĘČ”ĀČĘųµÄ×°ÖĆĶ¼£¬Ēėøł¾ŻøĆĶ¼»Ų“šĻĀĮŠĪŹĢā£®
ČēĶ¼ĪŖŹµŃéŹŅÖĘČ”ĀČĘųµÄ×°ÖĆĶ¼£¬Ēėøł¾ŻøĆĶ¼»Ų“šĻĀĮŠĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
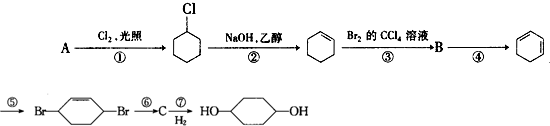

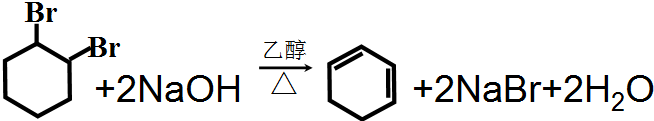 £®·“Ó¦¢ŽµÄ»Æѧ·½³ĢŹ½ŹĒ
£®·“Ó¦¢ŽµÄ»Æѧ·½³ĢŹ½ŹĒ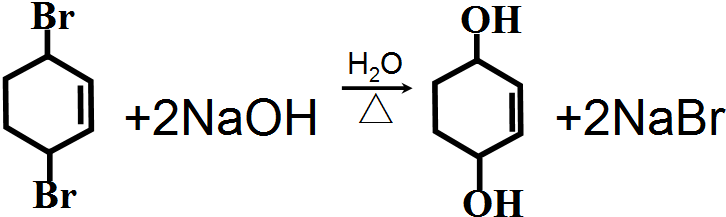 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘäĖ®ČÜŅŗĻŌĒæĖįŠŌ£¬Ė×³ĘŹÆĢæĖį | |
| B£® | ĘäÅØČÜŅŗ¶Ōʤ·ōÓŠĒæĮŅµÄøÆŹ“ŠŌ£¬Čē¹ū²»É÷Õ“ŌŚĘ¤·ōÉĻ£¬Ó¦Į¢¼“ÓĆ¾Ę¾«²ĮĻ“ | |
| C£® | ĘäŌŚĖ®ÖŠµÄČܽā¶ČĖęĪĀ¶ČµÄÉżø߶ųŌö“󣬳¬¹ż65”ęæÉŅŌÓėĖ®ŅŌČĪŅā±Č»„ČÜ | |
| D£® | ĀČ»ÆĢśČÜŅŗÖŠµĪČė±½·ÓµÄĖ®ČÜŅŗŗó£¬ČÜŅŗ³Ź×ĻÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČ»ÆĀĮČÜŅŗÖŠ¼ÓČė¹żĮæµÄ°±Ė®£ŗAl3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B£® | ³ĪĒåŹÆ»ŅĖ®ÓėĖÕ“ņČÜŅŗ»ģŗĻ£ŗCa2++OH-+HCO3-=CaCO3”ż+H2O | |
| C£® | ĀČ»ÆŃĒĢśČÜŅŗÖŠĶØČėĀČĘų£ŗ2Fe2++Cl2=2Fe3++2Cl- | |
| D£® | Ģ¼ĖįøĘČÜÓŚ“×Ėį£ŗCaCO3+2H+=Ca2++CO2”ü+H2O |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com