
某无色溶液可能含有下列钠盐中的几种:
A.氯化钠
B.硫化钠
C.亚硫酸钠
D.硫代硫酸钠
E.硫酸钠
F.碳酸钠
向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生,此气体有臭鸡蛋气味,可使澄清石灰水变浑浊,不能使品红褪色.
根据上述实验现象回答下列问题:
(1)不能使品红溶液褪色,说明该气体中不含________(填分子式).
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母):
第一种情况是________.
第二种情况是________.
第三种情况是________.
第四种情况是________.
(可不填满,也可补充)
(提示:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O)
|
【解答】(1)不含SO2;(2)①B,C,F;②B,D,F 【巧解导析】根据性质条件进行分析,在无色溶液中加入适量的稀硫酸,产生气体,此气体有臭鸡蛋气味,可使澄清石灰水变浑浊,证明气体中含有CO2和H2S,因此气体不能使品红褪色,故不含SO2(由SO2和H2S不可共存也可推断).故该无色溶液中必含Na2CO3和Na2S.因为在加酸后的反应中,除产生气体外,还有浅黄色沉淀析出,说明有单质硫生成,硫可由下列反应产生: 若溶液中含有Na2SO3,可发生如下反应: Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ Na2S+H2SO4=Na2SO4+H2S 2H2S+SO2=3S↓+2H2O 当n(Na2S)∶n(Na2SO3)>2∶1时,产生的H2S可将全部产生的SO2还原且有剩余.故混合气体含H2S而无SO2,溶液中出现浅黄色沉淀,符合题意. 若溶液中不含Na2SO3,而含Na2S2O3,加入稀硫酸时可发生如下反应: Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O Na2S+H2SO4=Na2SO4+H2S↑ 2H2S+SO2=3S↓+2H2O 若n(Na2S)∶n(Na2S2O3)>2∶1则反应产生的SO2将全部被还原为S,且H2S还有剩余,同样符合题意.由此可以确定符合条件的最简组合: (1)溶液中含有Na2CO3,Na2S,Na2SO3; (2)溶液中含有Na2CO3,Na2S,Na2S2O3. 如果溶液中含有Na2CO3,Na2S,Na2SO3,Na2S2O3四种物质,完全有可能出现题中所述实验现象,但这种组合不符合题设的“至少”的限定,不能作为本题的答案.符合题意的仅以上两种组合. |
|
【巧解点悟】在了解H2S和SO2之间的反应后,我们可从它们的反应与相应盐的性质联系在一起,以Na2S和Na2SO3为例,当它们与酸(例如稀硫酸或盐酸)反应时可产生气体: Na2S+H2SO4=Na2SO4+H2S↑ Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 而生成的气体又可反应生成单质硫: 2H2S+SO2=2H2O+3S↓ 将上述反应相加可得总方程式为: 2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O 由此可知,将Na2S和Na2SO3组成的混合物,加入足量的稀硫酸时,反应结果可能出现以下三种情况: (1)当n(Na2S)∶n(Na2SO3)=2∶1时,反应生成硫单质. (2)当n(Na2S)∶n(Na2SO3)>2∶1时,反应生成硫单质,并放出臭鸡蛋味的H2S气体. (3)当n(Na2S)∶n(Na2SO3)<2∶1时,反应生成硫单质,并放出使品红溶液褪色的SO2气体. 要注意的是,仅Na2S和Na2SO3混合并不发生上述反应,若在混合液中加入碱液(如NaOH)也无上述反应发生,原因是不能产生H2S和SO2气体,无法反应. 若在上述混合液中加入浓硫酸或硝酸,由于它们的强氧化性,可将H2S氧化,硝酸还可将SO2氧化,故反应现象将不同于上述情况. |


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ( I)某无色稀溶液X中,可能含有下表所列离子中的某几种.
( I)某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
(1)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质有许多相似之处。已知锡元素具有如下性质:
 ;
;




 。
。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:_____________________________________________________,_______________________________________。
②将①中溶液蒸干后继续灼烧所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是__________(填化学式)。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱可选用________。
(2)某无色稀溶液X中,可能含有下表所列离子中的某几种。
|
阴离子 |
|
|
阳离子 |
|
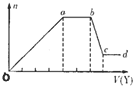
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示。

①若Y是盐酸,则溶液中含有的金属阳离子是_________,ab段发生反应的离子方程式为_______________,图中oa段参加反应的阴离子的物质的量之比为___________________。
②若Y是NaOH溶液,则bc段反应的离子方程式为____________________。
若不考虑离子的水解,忽略H+和OH-的影响,且溶液中只存在四种离子,则它们的离子个数比为_____________________________________________(按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列)。
查看答案和解析>>
科目:高中化学 来源:2010年河北省高二第二学期期中考试化学试题 题型:选择题
下列各条件下可能共存的离子组是
A.某无色溶液中:NH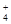 、Na+、Cl-、MnO
、Na+、Cl-、MnO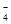
B.在含有大量I-离子的溶液中:Cl¯、Fe3+、Al3+、Cu2+
C.在c(H+)=1×10-13mol·L-1的溶液中:NH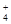 、Al3+、SO
、Al3+、SO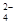 、CO
、CO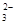
D.在加入Al能放出大量H2的溶液中:NH4+ 、SO42¯ 、C1¯、Na+
查看答案和解析>>
科目:高中化学 来源:2010年四川省高三9月月考化学试题 题型:实验题
( 14 分)某无色透明溶液可能含有下列离子:K+、Fe3+、Cu2+、Ba2+、AlO、NO3━、CO32-、SO32-、SO42-、Br-、I-、Cl-。取该溶液按如下步骤进行实验。
(1)请你根据下表Ⅰ栏中的实验结果,回答Ⅱ栏中有关问题:
|
Ⅰ实验结果 |
Ⅱ回答问题 |
|
①取原溶液少许,滴加足量氯水,产生沉淀;过滤,滤液加CCl4,振荡后,CCl4层未变色。 |
①该步实验说明溶液中不存在 离子_________________。 |
|
②取原溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色。 |
②该步实验发生反应的离子方程式为 _________________。 |
|
③取原溶液少许,加盐酸酸化后,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失。 |
③产生白色沉淀的离子方程式为 _________________。 |
|
④取原溶液少许,滴加2滴酸性高锰酸钾溶液,紫色立即褪去。 |
④该步实验说明溶液中存在 离子 _________________。 |
|
⑤取原溶液少许,加足量Ba(NO3)2溶液产生白色沉淀,过滤;往洗涤后的沉淀中加入足量盐酸,沉淀部分溶解,有无色气体产生。 |
⑤未溶解的白色沉淀是 ;将气体通入品红溶液的现象是 。 |
|
⑥取步骤⑤所得滤液,加HNO3酸化后,再加AgNO3溶液,溶液中析出白色沉淀。 |
⑥该步骤是否有意义 (填“有”或“无”)。 |
(2)综上,该溶液的pH (填“>”、“<”或“=”)7;该溶液中一定存在的阳离子是 ,不能确定是否存在的离子是 ;现欲取原溶液检验其是否存在,是否要使用试剂,若不要使用试剂,其实验方法是 ;若要使用试剂,选用的试剂是(按使用的先后顺序依次写出)
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com