
【题目】下列实验方案能达到目的的是( )
A.用浓硫酸干燥NH3
B.用乙醇萃取碘水中的碘单质
C.用加热的方法除去NaCl固体中的少量NaHCO3
D.用KSCN溶液鉴别Fe2(SO4)3溶液和FeCl2溶液
科目:高中化学 来源: 题型:
【题目】下图是铅蓄电池的工作原理示意图,电池总反应式是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,则下列说法正确的是
2PbSO4+2H2O,则下列说法正确的是

A. 放电时:PbO2做负极
B. 充电时:硫酸浓度增大
C. 充电时:B应与电源的正极相连
D. 放电时:正极反应是Pb-2e-+SO![]() =PbSO4
=PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) △H1
O2(g)=H2O(g) △H1
![]() N2(g)+O2(g)=NO2(g) △H2
N2(g)+O2(g)=NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H3
H2(g)=NH3(g) △H3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的△H为
O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2-2△H3 B. △H1+△H2-△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2-2△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的一组是…………………………………………( )
A.K+、NO3-、Na+、CO32-B.Na+、Cl-、H+、HCO3-
C.Mg2+、Al3+、Cl-、OH-D.Ca+、CO32-、K+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含 Na+、K+、NH4+、Mg2+、Cu2+、SO32﹣、SO42﹣和 Cl﹣中的几种。将试样平均分成甲、乙、丙各 100mL 三份,每次均加入足量的试剂,设计如下实验。

已知:SO32﹣+Br2+H2O=SO42﹣+2Br﹣+2H+
下列说法正确的是( )
A.溶液中可能含有 Na+、K+、Cu2+
B.溶液中一定含有 Cl﹣、SO42﹣和 Mg2+,且 c(Cl ﹣)=0.2 molL﹣1
C.可能存在的阳离子可用焰色反应进一步检验确认
D.溶液中一定不含 Na+、K+、NH4+、Cu2+、SO32﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验方案可以从海洋生物中提取具有抗肿瘤活性的天然物质:
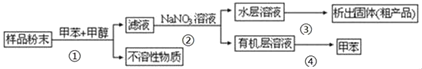
已知:甲苯,甲醇均为有机溶剂。
(1)指出抗肿瘤活性物质提取操作过程中有关的实验操作名称①_____④_____。
(2)操作①中用到的主要玻璃仪器有_____。
(3)操作②在用装置分液漏斗进行操作时,为使液体顺利滴下,应进行的具体操作是_____。 分液时要注意及时_____,防止上层液体流下。分液后漏斗内剩余的液体从分液漏斗 的_____(填“上口”或“下口”)倒入烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置如下图所示,则下列说法中错误的是

A. X元素的最外层电子数为2
B. Y的气态氢化物的化学式为HY
C. Z的最高价氧化物的化学式为ZO2
D. X、Y、Z的单质中X单质最稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:
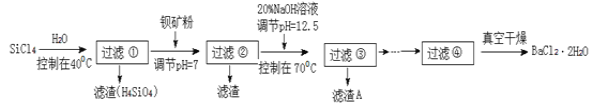
已知:①常温下Fe3+ 、Mg2+ 完全沉淀的 pH 分别是3.4、12.4。
②Ge与Si同主族位于Si的下一周期。
(1)Ge的原子序数________
(2)请用电子式表示C2H2的形成过程_____________________________。
(3)SiCl4发生水解反应的化学方程式____________________________。
(4)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式_____________________________________。
(5)加钡矿粉调节pH=7的作用是:①使BaCO3转化为BaCl2;②________________________
(6)生成滤渣A的离子方程式:______________________________;
(7)BaCl2滤液经__________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(8)10 吨含78.8% BaCO3的钡矿粉理论上最多能生成 BaCl2·2H2O___________吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com