
| A. | 硬度:白垩<金刚石 | B. | 熔点:Na<Mg | ||
| C. | 沸点:H2O<H2S | D. | 在水中溶解性:乙酸丁酯<乙酸 |
分析 A、原子晶体的硬度大于离子晶体;
B、金属晶体中阳离子半径越小,所带电荷越多,则金属键越强,金属的熔点越高;
C、水分子间存在氢键,而硫化氢分子间无氢键;
D、酯是难溶于水,而低级的脂肪酸是易溶于水.
解答 解:A、白垩是细小的碳酸钙是离子晶体硬度小于金刚石,故A正确;
B、金属晶体中阳离子半径越小,所带电荷越多,则金属键越强,金属的熔点越高,则离子半径:Na+>Mg2+,所以熔点:Na<Mg,故B正确;
C、水分子间存在氢键,而硫化氢分子间无氢键,所以沸点:H2O>H2S,故C错误;
D、酯是难溶于水,而低级的脂肪酸是易溶于水,所以在水中溶解性:乙酸丁酯<乙酸,故D正确;
故选C.
点评 本题考查不同类型晶体的硬度、金属晶体的熔点的高低、氢键的相关知识以及物质的溶解度,题目难度不大,综合性强,答题时要注意把握规律.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:C2H4 | B. | NaH中氢离子的结构示意图: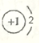 | ||
| C. | NH4I的电子式: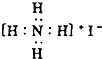 | D. | H2O、CO2的比例模型都可以用 表示 表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为铁,负极为铁,电解质溶液为CuCl2溶液 | |
| B. | 正极为银,负极为铁,电解质液为Fe(NO3)3溶液 | |
| C. | 正极为碳,负极为锌,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为碳,负极为铁,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g N2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L N2含有的分子数目为NA | |
| C. | lmol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、HCO3-、Cl- | |
| C. | 1.0 mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
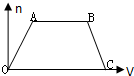 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是( )| A. | ③① | B. | ②⑤ | C. | ⑤④ | D. | ④② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25a | B. | 0.35a | C. | 0.45a | D. | 0.50a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com