
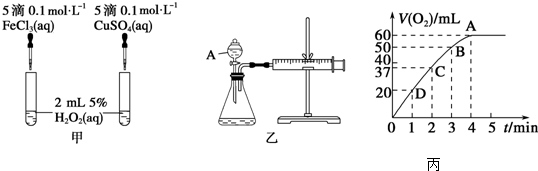
分析 (1)比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排斥阴离子的干扰;H2O2在二氧化锰催化作用下分解产生水和氧气;A仪器名称是分液漏斗;根据v=△c/△t分析实验中还需要测量的数据是时间;
(2)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,根据2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑进行计算;
(3)根据Zn+H2SO4=ZnSO4+H2↑,v=△c/△t进行计算.
解答 解:(1)该反应中产生气体,可根据生成气泡的快慢判断,氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,A仪器名称是分液漏斗;根据v=△c/△t知,还需要测定产生40mL气体所需的时间,
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,则n(H2O2)=$\frac{0.06L}{22.4L/mol}$×2≈0.00536 mol,c(H2O2)=$\frac{0.00536mol}{0.05L}$≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=$\frac{0.002mol}{0.04L×10s}$=0.005mol•L-1•s-1,
故答案为:0.005.
点评 本题考查实验方案设计,根据v=△c/△t来设计实验,通过得到气体的体积和时间的关系确定影响反应速率的因素,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(5)(6) | B. | (1)(4)(5) | C. | (2)(4)(6) | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
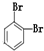
| A. | CH3CH2CHBrCH2Br | B. | CH3CHBrCHBrCH3 | C. | 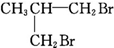 | D. | 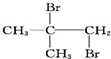 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用直馏汽油萃取,分液 | |
| B. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| C. | 乙烯中含有SO2,将其通入装有KMnO4溶液的洗气瓶中进行洗气 | |
| D. | 乙烷中含有乙烯,通入适量的H2在一定条件下反应使乙烯转变成乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⑪
⑪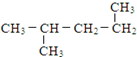 ⑫
⑫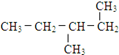
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com