
| A、高锰酸钾分解 |
| B、盐酸和氢氧化钠溶液反应 |
| C、铝片放入稀盐酸 |
| D、甲烷的燃烧 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁片插入硝酸铜溶液Fe+Cu2+→Fe3++Cu |
| B、石灰石和盐酸反应CO32-+2H+→CO2↑+H2O |
| C、氢氧化镁与稀盐酸反应Mg(OH)2+2H+→Mg2++2H2O |
| D、硫酸与氢氧化钡溶液反应H++OH-→H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氢氧化钡溶液与等物质的量的稀H2SO4混合:Ba2++OH-+H++SO
| ||||
| B、氨气通入醋酸溶液中:CH3COOH+NH3═CH3COONH4 | ||||
C、碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO
| ||||
| D、澄清石灰水与盐酸反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
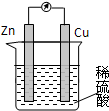
| A、锌作正极 |
| B、溶液中SO42-向铜电极方向移动 |
| C、电子由锌片通过导线流向铜 |
| D、负极发生的反应是:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
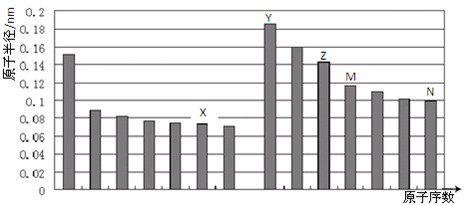
| A、N、Z两种元素的离子半径相比,前者较大 |
| B、M、N两种元素的气态氢化物的稳定性相比,后者较强 |
| C、X与M两种元素组成的化合物不能与碱发生反应 |
| D、工业上常用电解熔融态的Y和N形成的化合物制取Y的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| B、24g金属镁变为镁离子时失去的电子数为NA |
| C、1.8g水所含的电子数目为NA |
| D、标准状况下,78g苯中含有3NA个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
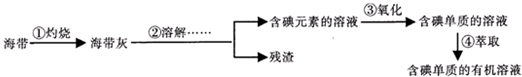
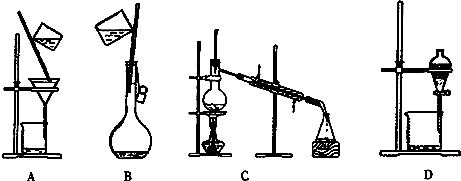
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com