
【题目】电解![]() 溶液,原理如图所示。下列说法正确的是( )
溶液,原理如图所示。下列说法正确的是( )
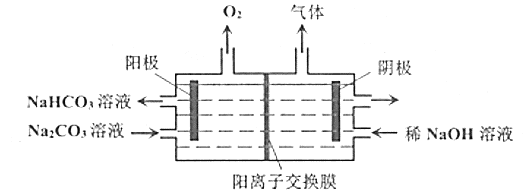
A.随着电解的进行,阴极区溶液的pH变小
B.![]() 从阴极穿过交换膜向阳极移动
从阴极穿过交换膜向阳极移动
C.若利用可逆反应原电池做此电解装置的电源,当原电池中发生的反应达平衡时,该电解装置不会停止工作
D.阳极电极反应式:![]()
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
科目:高中化学 来源: 题型:
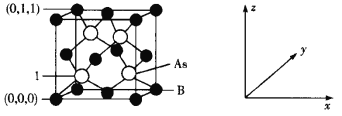
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已有知识判断下列说法正确的是( )
A.若X是第四周期中的一种“类硅”元素,则X单质不易与水反应
B.若![]() 与
与![]() 电子层结构相同,则原子序数
电子层结构相同,则原子序数![]() ,离子半径
,离子半径![]()
C.若①氯化钠溶液与②氯化铵溶液浓度相等,则常温下两种溶液中的Kw:②>①
D.若反应![]() 在一定条件下能够自发进行,则反应的
在一定条件下能够自发进行,则反应的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL 二氧化碳气体(在标准状况下)。求原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是多少?________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用等浓度的NaOH溶液,分别滴定浓度均为0.1 mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
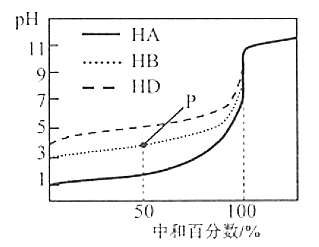
A.等浓度的三种酸中和等量的NaOH需要三种酸的体积:V(HA)>V(HB)>V(HD)
B.从滴定开始至pH=7时,三种溶液中水的电离程度逐渐增大
C.滴定至P点时,溶液中:c(HB)+c(H+)=c(B-)+c(OH-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com