
| A. | 苯与Fe、Br2混合 | B. | 氯乙烷和NaOH溶液共热 | ||
| C. | 乙烯和溴水反应 | D. | 溴乙烷和NaOH的乙醇溶液共热 |
分析 有机物中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键或苯环状)化合物的反应,叫做消去反应,据此分析解答.
解答 解:A.在溴化铁作催化剂条件下,苯和液溴发生取代反应生成溴苯,反应类型是取代反应,故A错误;
B.氯乙烷和NaOH的水溶液加热发生取代反应生成乙醇,反应类型是取代反应,故B错误;
C.乙烯和溴发生加成反应生成1,2-二溴乙烷,反应类型是加成反应,故C错误;
D.溴乙烷和NaOH的醇溶液共热发生消去反应生成乙烯,反应类型是消去反应,故D正确;
故选D.
点评 本题考查有机反应基本类型,侧重考查基本概念,明确取代反应、加成反应、消去反应特点是解本题关键,注意:只有连接卤原子碳原子相邻碳原子上含有氢原子的卤代烃能发生消去反应,为易错点.


科目:高中化学 来源: 题型:解答题

 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$ +CH3CH2OH.M与新制氢氧化铜悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O
+CH3CH2OH.M与新制氢氧化铜悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O 、
、 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
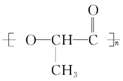 在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸是一种羧酸 | |
| C. | 聚乳酸的单体 | |
| D. | 其聚合方式与聚苯乙烯的聚合方式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125mol | B. | 0.375mol | C. | 0.5mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
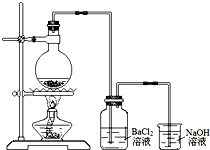 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com