
| A. | 可用细铁丝代替铂丝做焰色反应实验 | |
| B. | 容量瓶使用前须烘干 | |
| C. | 可用CCl4将溴水中的溴单质分离除净 | |
| D. | 用元素分析仪确定物质中含有哪些金属元素 |
分析 A、铁元素的焰色反应为无色;
B、容量瓶在使用前不必烘干;
C、溴在四氯化碳中的溶解度比在水中的大;
D、现代化学分析中,常借助一些仪器来分析化学物质的组成,用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素.
解答 解:A、铁元素的焰色反应为无色,故对焰色反应不构成影响,故可以代替铂丝,故A正确;
B、容量瓶在使用前有没有少量的水对实验结果无影响,故不必烘干,故B错误;
C、溴在四氯化碳中的溶解度比在水中的大,故可以用四氯化碳萃取溴水中的溴,但不能将溴彻底萃取干净,故C错误;
D、元素分析仪作为一种实验室常规仪器,可同时对有机的固体、高挥发性和敏感性物质中C、H、N、S、元素的含量进行定量分析测定,而不能测定金属元素,故D错误;
故选A.
点评 本题考查实验室中的常见的实验方法和仪器的使用,题目难度不大,对于D来说,我们可能较为陌生,学习中注意开拓视野,加强相关知识的积累.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将SO2通入Ba(NO3)2溶液中 | 溶液出现浑浊 | 沉淀的主要成分是BaSO3 |
| B | 将少量溴水滴入FeI2溶液中,再加入CCl4振荡,静置 | 下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 将少量浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 硝酸的还原产物是NO2 |
| D | 将CO2通入Na2SiO3溶液中 | 有白色沉淀生成 | H2CO3酸性比H2SiO3强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molSO2、0.5molO2、1molSO3 | B. | 4molSO2、2molO2 | ||
| C. | 4molSO3 | D. | 1molSO2、1molO2、1molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
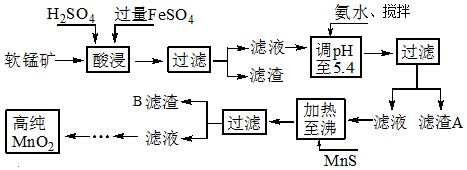
| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 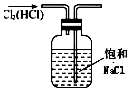 用图所示装置可得到纯净的Cl2 | |
| B. | 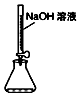 用图量取15.00mL的NaOH溶液 | |
| C. | 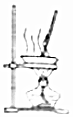 用图所示装置蒸发FeCl3溶液制备无水FeCl2 | |
| D. |  关闭分液漏斗的活塞,从b处加水,以检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低,极易被引燃,加热时最好用水浴加热 | |
| B. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 苹果放在空气中久置变黄和纸张久置变黄原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
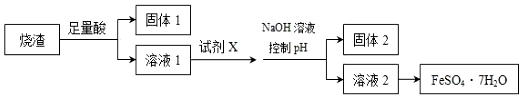
| A. | 溶解烧渣选用足量硫酸,试剂 X 选用铁粉 | |
| B. | 固体1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 | |
| C. | 从溶液 2 得到 FeSO4•7H2O 产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到 FeSO4•7H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com