
| 0.466g |
| 233g/mol |
| ||
| 0.05L |
| 0.466g |
| 233g/mol |
| ||
| 0.05L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
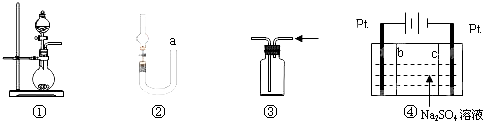
| A、图①可用于实验室制取少量NH3或O2 |
| B、可用从a处加水的方法检验图②装置的气密性 |
| C、实验室可用图③的方法收集Cl2或NH3 |
| D、利用图④装置制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| B、用二氧化硫加工银耳,使之更白 |
| C、二氧化锰具有强氧化性,故能将双氧水氧化为氧气 |
| D、NH3极易溶于水,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2═Na2O2 |
| B、将KIO3溶液滴入含有淀粉的酸性KI溶液中,溶液变蓝:5I-+IO3-+3H2O═3I2+6OH- |
| C、硅酸钠溶液与醋酸溶液混合,产生白色沉淀:SiO32 -+2H+═H2SiO3↓ |
| D、向NaAlO2溶液中通入过量CO2,产生白色沉淀:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA |
| B、标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2NA |
| C、NO2和H2O反应每生成2molHNO3时转移的电子数目为2NA |
| D、lmolFe在氧气中充分燃烧失去3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+| 放电 |
| 充电 |
| A、氧化性:Cr3+>Fe3+ |
| B、电池放电时,负极的电极反应式为Fe2+-e-═Fe3+ |
| C、充电时,阴极的电极反应式为Cr3++e-═Cr2+ |
| D、电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用物质结构的知识完成B、N元素的问题.
运用物质结构的知识完成B、N元素的问题.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com