
| A、醋酸与锌反应放出的H2多 |
| B、盐酸与醋酸分别与锌反应放出的H2一样多 |
| C、醋酸与锌反应速率大 |
| D、盐酸与醋酸分别与锌反应的速率一样大 |
| 0.03g |
| 65g/mol |
| 0.03g |
| 65g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M>N>P>Z |
| B、M>N>Z>P |
| C、Z>P>M>N |
| D、P>M>N>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑦⑧ | B、②④⑦ |
| C、①⑥ | D、②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热的纯碱去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污能力增强 | ||||
| B、铁在潮湿的环境下生锈与盐类水解有关 | ||||
| C、将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3 | ||||
D、将FeCl3饱和溶液滴入沸水中制胶体,离子方程式为Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
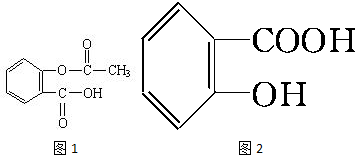
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
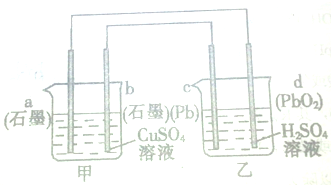
| A、电极b为阳极 |
| B、电极a上发生的反应为Cu2++2e-═Cu |
| C、工作时,装置甲中溶液的pH减小 |
| D、外电路中电子流动方向为由b经导线到c |
查看答案和解析>>
科目:高中化学 来源: 题型:
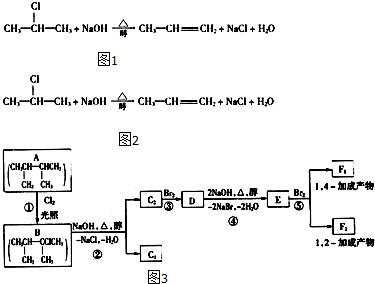
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com