
| A. | 使用二氧化钛作催化剂使水快速分解的同时放出大量热 | |
| B. | 该过程涉及到的反应为氧化还原反应 | |
| C. | 该反应的原理是:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2+O2 | |
| D. | 每产生氢气44.8L,转移电子数目为2NA |
分析 A.水分解是吸热反应;
B.存在化合价的变化的反应是氧化还原反应;
C.该反应的原理是:2H2O$\frac{\underline{\;TiO_{2}\;}}{光照}$2H2↑+O2↑;
D.状况不知,无法由体积求物质的量.
解答 解:A.催化剂的使用未改变反应的热效应,而水分解是吸热反应,故A错误;
B.存在化合价的变化的反应是氧化还原反应,该反应中H、O元素的化合价发生变化,故B正确;
C.二氧化钛(TiO2)作催化剂可以使水在光照条件下分解制得廉价的氢气,该反应的原理是:2H2O$\frac{\underline{\;TiO_{2}\;}}{光照}$2H2↑+O2↑,故C错误;
D.状况不知,无法由体积求物质的量,所以转移电子数目不知,故D错误;
故选B.
点评 本题考查了氧化还原反应、化学反应中的能量变化、气体摩尔体积的应用、以及方程式的书写,题目综合性强,但比较容易,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
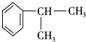
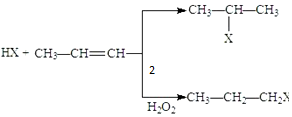 (X为卤素原子)
(X为卤素原子)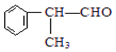 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$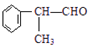
 .
.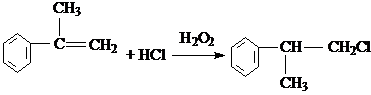 、2
、2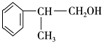 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.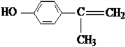 、
、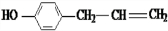 、
、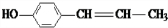 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 463kJ•mol-1 | B. | 926kJ•mol-1 | C. | 1852kJ•mol-1 | D. | 920kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
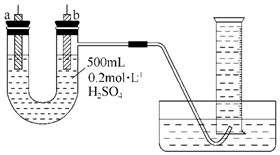 给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com