
| 温度℃ | 400 | 500 | 830 | 1000 |
| 平均常数K | 10 | 9 | 1 | 0.6 |
| A. | 上述反应中正反应是吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{\{c({H}_{2})•c(C{O}_{2})\}}{\{c(CO)•c({H}_{2}O)\}}$ | |
| C. | 该反应在400℃时达平衡状态,若升高温度,则正反应速率减小,逆反应速率增大 | |
| D. | 在830℃,2L的密闭容器中,冲入1molCO、5molH2O(g)、3molCO2和2molH2发生上述反应,在达到平衡前V(正)<V(逆) |
分析 A、根据平衡常数随温度的变化分析平衡移动方向,结合平衡移动原理分析判断;
B、平衡常数等于各个生成物平衡浓度系数次幂之积和各个产物平衡浓度系数次幂之积的比值,据此回答;
C、升高温度,则化学反应的反应速率增大;
D、根据Qc和K之间的大小关系确定化学反应的方向.
解答 解:A、温度升高平衡常数减小,说明温度升高,平衡逆向进行,逆向是吸热反应,正向是放热反应,故A错误;
B、该反应的化学平衡常数表达式为K=$\frac{[{H}_{2}]•[C{O}_{2}]}{[CO]•[{H}_{2}O]}$,故B正确;
C、该反应在400℃时达平衡状态,若升高温度,则正反应速率增大,逆反应速率增大,故C错误;
D、在830℃,2L的密闭容器中,冲入1molCO、5molH2O(g)、3molCO2和2molH2发生上述反应,此时Qc=$\frac{3×2}{1×5}$=1.2>K,所以在达到平衡前V(正)<V(逆),故D正确.
故选BD.
点评 本题考查了化学平衡的平衡常数应用和影响条件分析,主要是平衡移动原理的运用,数据分析能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
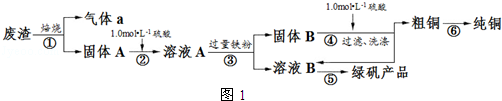
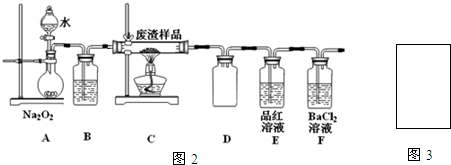
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
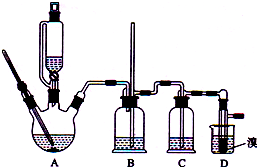 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
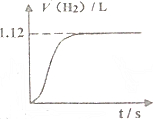 常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)
常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按照规定对生活废弃物进行分类放置,实现资源再利用 | |
| B. | 防治环境污染、开发智能软件、合成新材料等,都属于化学研究的领域 | |
| C. | 利用人工光合成反应,将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 | |
| D. | 液晶态介于晶体状态和液态之间,液晶具有有一定程度的晶体的有序性和液体的流动性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24LNH3和CH4的混合气体,所含电子总数为2NA | |
| B. | 1mol乙醇(CH3CH2OH)分子中含有共价键总数为8NA | |
| C. | 1mol/LNa2CO3溶液中,含有CO32-离子数为NA | |
| D. | 6.4gCu与足量浓硝酸反应,用排水法收集的气体分子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com