
| A. | 0.022mol•L-1 | B. | 0.045mol•L-1 | C. | 0.8mol•L-1 | D. | 无法计算 |
分析 混合气体中HCl溶于水,溶液体积等于HCl的体积,假设HCl为1L,根据n=$\frac{V}{{V}_{m}}$计算HCl物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:混合气体中HCl溶于水,溶液体积等于HCl的体积,假设HCl为1L,则溶液体积为1L,标况下1L HCl物质的量为$\frac{1L}{22.4L/mol}$=$\frac{1}{22.4}$mol,则溶液物质的量浓度为$\frac{\frac{1}{22.4}mol}{1L}$=00045mol/L,
故选:B.
点评 本题考查物质的量有关计算,题目中平均相对分子质量为干扰数据,关键是明确HCl体积等于溶液体积.


科目:高中化学 来源: 题型:选择题
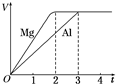
| A. | 镁和铝的物质的量之比为3:2 | B. | 镁和铝转移电子数之比为1:1 | ||
| C. | 镁和铝的摩尔质量之比为8:9 | D. | 镁和铝反应所用时间之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
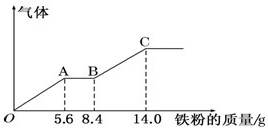 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )| A. | 原混合溶液中NO${\;}_{3}^{-}$的物质的量的浓度为4mol/L | |
| B. | AB段的反应为:Fe+2Fe3+=3Fe2+ | |
| C. | C点时,乙中溶质为FeSO4 | |
| D. | 标准状况下,OA,OB段产生的气体总体积约为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”).
该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:丙是甲的二倍 | |
| B. | 三个容器内反应的平衡常数:甲=乙>丙 | |
| C. | 达平衡时氨气的体积分数:甲>乙>丙 | |
| D. | 放出热量关系:b<a<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
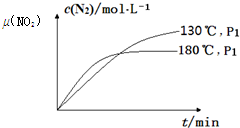 CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g 苯中含有的单键数目为0.9NA | |
| B. | 1 mol Cl2溶于水,与水反应时电子转移数目为1 NA | |
| C. | 在298K 1.01×105pa下,22 g CO2和N2O混合气体中,所占的体积大于11.2升 | |
| D. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com