
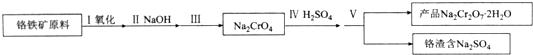
分析 (1)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
升高温度、增大氧气浓度、增大接触面积等可以加快反应速率;
②与氢氧化钠反应得到含有铝、硅元素的化合物,应是偏铝酸钠、硅酸钠;
③步骤Ⅲ需将溶液的pH调至7〜8并煮沸,使偏铝酸根、硅酸根转化为氢氧化铝、硅酸沉淀过滤除去;
④Na2CrO4与硫酸反应得到Na2Cr2O7、Na2SO4;
(2)NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大,先蒸发浓缩析出NaCl,趁热过滤防止K2Cr2O7晶体,滤液经过冷却结晶、过滤得到K2Cr2O7晶体.
解答 解:(1)①步骤I中反应的化学方程式为:4FeO•Cr2O3(s)+8Na2CO3(s)+7O2═8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式K=$\frac{{c}^{8}(C{O}_{2})}{{c}^{7}({O}_{2})}$,
A.升高温度可以加快反应速率,故A正确;
B.通入过量的空气,增大氧气浓度,反应速率加快,故B正确;
C.将原料粉碎,增大反应物之间的接触面积,反应速率加快,故C正确;
D.增加纯碱的用量,不影响反应速率,故D错误,
故答案为:$\frac{{c}^{8}(C{O}_{2})}{{c}^{7}({O}_{2})}$;ABC;
②与氢氧化钠反应得到含有铝、硅元素的化合物,应是NaAlO2、Na2SiO3,
故答案为:NaAlO2、Na2SiO3;
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,NaAlO2、Na2SiO3等杂质可以以沉淀的形式除去,
故答案为:除去A1O-2、SiO32-等杂质;
④该步骤是CrO42-到Cr2O72-的转化,反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O,
故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(2)NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大,分离NaCl、K2Cr2O7,将混合物溶解后,先蒸发浓缩析出NaCl,趁热过滤防止K2Cr2O7晶体,滤液经过冷却结晶、过滤得到K2Cr2O7晶体,
故答案为:蒸发; 趁热过滤.
点评 本题考查物质制备实验,注意根据各问题进行分析解答,涉及化学平衡常数、化学反应速率影响因素、物质的分离提纯,注意理解利用溶解度进行物质的分离,充分考查学生的分析、理解能力及化学实验能力,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
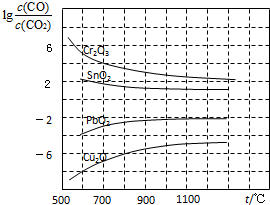 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
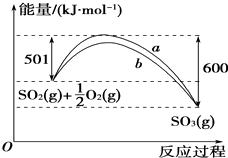 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2在任何情况下都是32g | B. | 摩尔是一个基本物理量 | ||
| C. | H2SO4的摩尔质量是98g | D. | 1摩尔氢的质量是2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
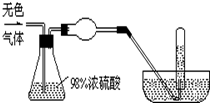 有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | Mg2+、NO3-、OH-、Na+ | D. | MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com