
(9分)已知实验室制氢气的反应:Zn+2HCl= ZnCl2+H2↑。现用13.0gZn粉与一定量2mol/L稀盐酸充分反应,一段时间后Zn粉无剩余,则盐酸的体积至少为多少升?生成ZnCl2的物质的量为多少?标准状况下,最多能收集到多少升气体?
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
已知工业制氢气的反应为CO(g) + H2O(g) ![]() CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
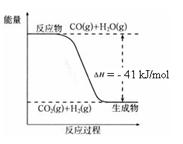
(1)增加H2O(g)的浓度,CO的转化率将 (填“增大”“减小”或“不变”)。
(2)平衡常数的表达式K = 。400 ℃时的平衡常数K 9(填“>”“<”或”“=”)。
(3)500 ℃时,10 min内v(H2O)= ,在此过程中体系的能量将 (填“增加”或“减少”) kJ。
(4)已知 2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol
结合上图写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知工业制氢气的反应为CO(g) + H2O(g) CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
(1)增加H2O(g)的浓度,CO的转化率将 (填“增大”“减小”或“不变”)。
(2)平衡常数的表达式K = 。400 ℃时的平衡常数K 9(填“>”“<”或”“=”)。
(3)500 ℃时,10min内v(H2O)= ,在此过程中体系的能量将 (填“增加”或“减少”) kJ。
(4)已知 2H2 (g) + O2 (g) = 2H2O(g) ΔH=-484kJ/mol
结合上图写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高一第一次月考化学试卷(解析版) 题型:计算题
(9分)已知实验室制氢气的反应:Zn+2HCl= ZnCl2+H2↑。现用13.0gZn粉与一定量2mol/L稀盐酸充分反应,一段时间后Zn粉无剩余,则盐酸的体积至少为多少升?生成ZnCl2的物质的量为多少?标准状况下,最多能收集到多少升气体?
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市朝阳区高三第一学期期末考试化学试卷 题型:填空题
已知工业制氢气的反应为CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2
L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2
L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
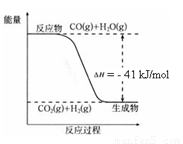
(1)增加H2O(g)的浓度,CO的转化率将 (填“增大”“减小”或“不变”)。
(2)平衡常数的表达式K = 。400 ℃时的平衡常数K 9(填“>”“<”或”“=”)。
(3)500 ℃时,10 min内v(H2O)= ,在此过程中体系的能量将 (填“增加”或“减少”) kJ。
(4)已知 2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol
结合上图写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com