
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
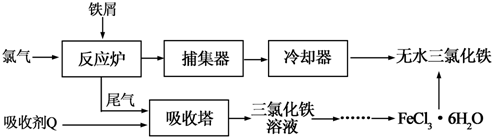
分析 氯气与铁在反应炉中反应生成氯化铁,尾气用吸收剂Q处理得到氯化铁,故Q为氯化亚铁,氯化铁溶液蒸发浓缩、冷却结晶得到氯化铁晶体,为防止氯化铁水解,在HCl气流中加热蒸干氯化铁晶体得到氯化铁,
(1)尾气中含有氯气,由工艺流程可知,用吸收剂X在吸收塔中吸收氯气,生成氯化铁,所以吸水剂X为氯化亚铁;
(2)由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加热浓缩、冷却结晶、过滤、洗涤、干燥,铁离子易水解应在氯化氢气流中加热FeCl3•6H2O晶体;
(3)依据沉淀溶解平衡的溶度积,结合溶液PH计算得到;
(4)SO2通入氯化铁溶液中,发生氧化还原反应生成硫酸根离子、铁离子;
(5)Fe3+会水解产生较多的H+:Fe3++3H2O?Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀,CuO促进铁离子水解.
解答 解:(1)尾气中含有氯气,由工艺流程可知,用吸收剂X在吸收塔中吸收氯气,生成氯化铁,所以吸水剂X为氯化亚铁,氯化亚铁与氯气反应生成氯化铁,
反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加加热浓缩;再冷却结晶,Fe3+易水解,所以由FeCl3•6H2O晶体得到无水FeCl3,应在氯化氢气流中加热FeCl3•6H2O晶体,得到无水FeCl3,
故答案为:加热浓缩;冷却结晶;在氯化氢气流中加热FeCl3•6H2O晶体,得到无水FeCl3;
(3)当溶液pH为4时,溶液中c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4×10-38,所以溶液中c(Fe3+)=$\frac{4×1{0}^{-38}}{(1{0}^{-10})^{3}}$=4×10-8 mol•L-1,
故答案为:4×10-8;
(4)SO2通入氯化铁溶液中,发生氧化还原反应生成硫酸根离子、铁离子,离子反应为SO2+2H2O+2Fe3+=2Fe2++4H++SO42-,
故答案为:SO2+2H2O+2Fe3+=2Fe2++4H++SO42-.
(5)因为Fe3+会水解产生较多的H+:Fe3++3H2O?Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀,
故答案为:Fe(OH)3;Fe3+会水解产生较多的H+:Fe3++3H2O?Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀.
点评 本题考查学生对工艺流程的理解、物质的分离提纯等基本操作、氧化还原反应滴定应用、溶度积有关计算等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
 的二氯代物有
的二氯代物有 (
( 是苯基,环用键线式表示,C、H原子都未画出)( )
是苯基,环用键线式表示,C、H原子都未画出)( )| A. | 3种 | B. | 4种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( )| A. | 脱氢反应的△H<0 | B. | 600 K时,Y点甲醇的v(逆)<v(正) | ||
| C. | 从Y点到Z点可通过增大压强 | D. | 在t1K时,该反应的平衡常数为8.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,也可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com