
| A. | 137Cs和133Cs互为同位素 | B. | 单质Cs与水反应非常缓慢 | ||
| C. | 137Cs比133Cs比多个中子 | D. | 137Cs最外层只有1个电子 |
分析 A.质子数相同,中子数不同,互为同位素;
B.Cs在第IA族,活泼性比钠强;
C.根据质量数=质子数+中子数计算;
D.第IA族元素原子的最外层电子数为1.
解答 解:A.137Cs和133Cs质子数相同,中子数不同,互为同位素,故A正确;
B.Cs在第IA族,活泼性比钠强,所以Cs与水反应非常剧烈,故B错误;
C.137Cs与133Cs质子数相同,137Cs比133Cs多4个中子,故C正确;
D.137Cs属于第IA族元素,第IA族元素原子的最外层电子数为1,故D正确;
故选B.
点评 本题考查原子结构和性质,题目涉及核内质子数、质量数、质子数、中子数的关系以及同主族元素的性质,题目难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 漂白粉溶液中通入足量二氧化硫气体:ClO-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| C. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | ||
| C. | 2KOH+MgCl2═Mg(OH)2↓+2KCl | D. | Zn+H2SO4═ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8g | B. | 1.6g | C. | 2.4g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
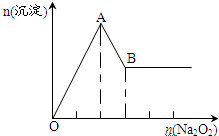 有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验
有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 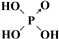 | 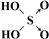 | 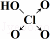 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com