
(14分).下表是部分短周期元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
Q |
M |
|
原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
0.160 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
-3,+5 |
+2 |
试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。M在Z的最高价氧化物中燃烧的化学方程式为 。
(2) 元素Z可形成多种同素异形体,其中有属于原子晶体的, 写出它的名称
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有 ;X可与w组成含18电子的共价化合物乙,则乙的电子式为 。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为 mol·L-1。
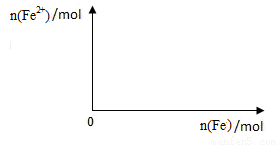
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:山西省模拟题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com