
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
分析 A.根据催化剂可以同等程度的增大正逆反应的反应速率;
B.增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;
C.降低温度反应速率减小;
D.根据v=$\frac{△c}{△t}$计算判断.
解答 解:A、催化剂可同等程度的改变正、逆反应的反应速率,故A错误;
B、若在恒容条件下,向容器通入惰性气体,反应体系的压强变大,但反应各物质的浓度不变,因此反应速率也不变,故B错误;
C、不论反应是吸热反应还是放热反应,降低温度反应速率一定变慢,则达到平衡的时间将延长,故C错误;
D、根据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1,故D正确;
故选:D.
点评 本题主要考查化学反应速率与化学平衡的影响的因素,化学反应速率计算等,B选项为易错点,注意理解压强对反应速率、化学平衡的影响,改变压强影响物质的浓度.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | E |
| A. | HnDOm为强酸时,E的非金属性一定很强 | |
| B. | A(OH)n为强碱时,B(OH)m也一定为强碱 | |
| C. | E元素的最高化合价为+7时,D元素的负化合价可为-2价 | |
| D. | HnCOm为强酸时,E的单质可能有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
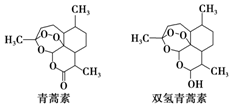 中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素通过还原反应可制得双氢青蒿素 | |
| C. | 青蒿素有青蒿的芳香气味,是芳香族化合物 | |
| D. | 用有机溶剂乙醚从青蒿中提取青蒿素,主要采用萃取的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 136.8kJ | B. | 110.9kJ | C. | 83.2kJ | D. | 82.4kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
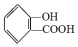 ,
,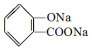 ;请写出将
;请写出将 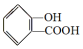 转化为
转化为 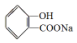 的化学方程式
的化学方程式 +NaHCO3→
+NaHCO3→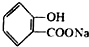 +H2O+CO2↑.
+H2O+CO2↑.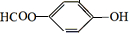
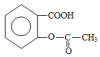 ,它与足量氢氧化钠溶液发生反应的方程式是
,它与足量氢氧化钠溶液发生反应的方程式是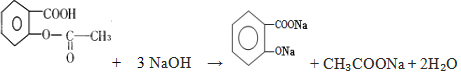 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
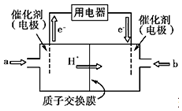 氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)
氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
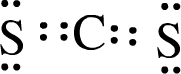 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com