
| A.H+(aq)+OH-(aq)═H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出的热量为a kJ |
| B.因CuSO4?5H2O(s)═CuSO4(s)+5H2O(l)△H=+b kJ/mol,故1 mol CuSO4(s)溶于水时,放出b kJ热量 |
| C.因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+c kJ/mol |
| D.因N2(g)+3H2(g)?2NH3△H=-d kJ/mol,故向某容器中通人1 mol N2与3 mol H2充分反应后,放出的热量小于d kJ |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ④ | ||||||
| 3 | ⑤ | ③ | ⑥ | ⑦ | ||||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
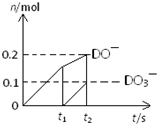
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X元素在空气中含量最高 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同主族,原子半径:Y>Z |
| W | W元素的一种氧化物具有磁性 |
| H | H元素形成的盐溶液一般呈蓝色 |
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(二)化学试卷(A卷)(带解析) 题型:填空题
[2012·北京大兴一模](11分)下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 ;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________ ___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________ __。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____ 。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com