
| n |
| M |
| 18.8g |
| 117.5g/mol |
| 4.32g |
| 18g/mol |
| 4.48L |
| 22.4L/mol |
| 2.24 |
| 14g/mol |
| 0.4mol×12 |
| 32 |


科目:高中化学 来源: 题型:
| A、Na+、K+、SO42-、Cl- |
| B、Fe2+、H+、SO42-、NO3- |
| C、H+、K+、HCO3-、Cl- |
| D、Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
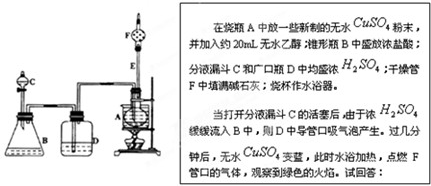
查看答案和解析>>
科目:高中化学 来源: 题型:
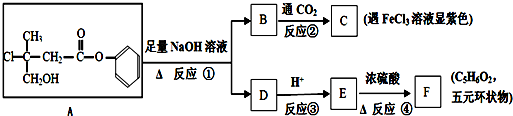
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用干冰保藏易变质的食品 |
| B、用硫磺熏制白木耳、粉丝等食品 |
| C、用甲醛浸泡易腐烂的食品 |
| D、用含亚硝酸钠的工业用盐腌制食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Ba2+)>c(OH-)>c(Na+)>c(SO42-) |
| B、c(Na+)>c(OH-)>c(Ba2+)>c(SO42-) |
| C、c(Na+)>c(Ba2+)>c(OH-)>c(SO42-) |
| D、c(OH-)>c(Ba2+)>c(Na+)>c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
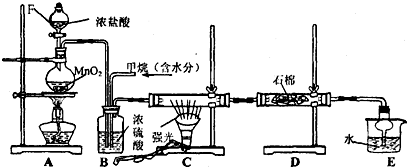
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 18×10-5 | 4.5×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2CO3)>pH(NaCN) |
| B、a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C、向0.1 mol?L-1CH3COOH溶液中逐滴加水,则醋酸的电离程度增大、c(H+)减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com