
|
某化学反应其ΔH=122 kJ/mol,ΔS=231 J/(mol·K),则此反应在下列哪种情况下可自发进行 | |
| [ ] | |
A. |
在任何温度下都能自发进行 |
B. |
在任何温度下都不能自发进行 |
C. |
仅在高温下自发进行 |
D. |
仅在低温下自发进行 |
科目:高中化学 来源:浙江省富阳场口中学2011-2012学年高二3月教学质量检测化学试题 题型:013
|
某化学反应其ΔH=-122 kJ·mol-1,ΔS=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 | |
| [ ] | |
A. |
在任何温度下都能自发进行 |
B. |
在任何温度下都不能自发进行 |
C. |
仅在高温下自发进行 |
D. |
仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源:福建省安溪一中、惠安一中、养正中学2011-2012学年高二上学期期中联考化学试题 题型:013
|
某化学反应其ΔH=-122 kJ·mol-1,ΔS=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 | |
| [ ] | |
A. |
在任何温度下都能自发进行 |
B. |
在任何温度下都不能自发进行 |
C. |
仅在高温下自发进行 |
D. |
仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
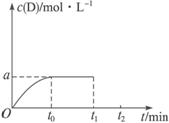
(1)Q___________0(填“>”或“<”)。
(2)t1至t2时间内,用D的物质的量浓度表示的化学反应速率v(D)=____________。
(3)在上图中作出t1至t2时间内的c(D)变化的曲线。
(4)t2时压强p2_________p0(填“>”“<”或“=”),原因是_________。
(5)对ΔH的判断正确的是_________。
A.变为2Q B.介于Q与2Q之间
C.减小 D.不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
以下是对化学反应变化过程及结果的研究。按要求回答问题:
Ⅰ.关于反应速率和限度的研究
(1)已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则等物质的量浓度的①CH3COONa、②NaCN、③Na2CO3、④NaHCO3溶液的pH由大到小的顺序为__________(填编号)。
(2)已知2SO2(g)+O2(g)??2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)=________。
(3)下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是________。
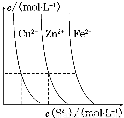
向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为________(填化学式)沉淀。
Ⅱ.关于电化学的研究
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:VO2++2H++V2+ V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省六市六校联盟高考模拟考试理科综合化学试卷(解析版) 题型:填空题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式???????????????????? 。
已知:? ① CO(g)+H2O(g) H2(g)+CO2(g)??? ΔH=-41kJ·mol-1
H2(g)+CO2(g)??? ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g)??????????? ΔH=-73kJ·mol-1
CH4(g)??????????? ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g)???? ????? ΔH=-171kJ·mol-1
C(s)+CO2(g)???? ????? ΔH=-171kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。
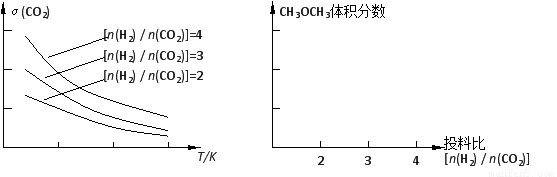
②某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是??? ? ??? ?? ;

A. P3>P2,T3>T2???????? B. P1>P3,T1>T3??? C. P2>P4,T4>T2???????? D. P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ????? ;
A. 正反应速率先增大后减小
B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大
D. 反应物的体积百分含量增大
E. 混合气体的密度减小
F. 氢气的转化率减小
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式__?????????????????????????? ?? 。以此燃料电池作为外接电源按图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是????????????????????? ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入?????? (填物质名称),其质量约为??? g。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com