
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA
C. 2.8g 的聚乙烯中含有的碳原子数为0.2 NA
D. 1mol 苯中含有碳碳双键的数目为3 NA
【答案】C
【解析】
A.1.8g甲基(-CD3)物质的量=![]() =0.1mol,甲基不显电性,故0.1mol-CD3含中子个数=0.1mol×[12-6+(2-1)×3]×NA=0.9NA,故A错误;
=0.1mol,甲基不显电性,故0.1mol-CD3含中子个数=0.1mol×[12-6+(2-1)×3]×NA=0.9NA,故A错误;
B.假设11.2L都是乙烯,则n(C2H4)=![]() =0.5mol,1mol乙烯分子中含有6mol共用电子对,则0.5mol乙烯分子中含有3mol共用电子对,假设11.2L都是环丙烷,则n(C3H6)=
=0.5mol,1mol乙烯分子中含有6mol共用电子对,则0.5mol乙烯分子中含有3mol共用电子对,假设11.2L都是环丙烷,则n(C3H6)=![]() =0.5mol,1mol环丙烷分子中含有9mol共用电子对,则0.5mol环丙烷分子中含有4.5mol共用电子对,故最终共用电子对数在3mol~4.5mol之间,即共用电子对数目为在3NA~4.5NA之间,故B错误;
=0.5mol,1mol环丙烷分子中含有9mol共用电子对,则0.5mol环丙烷分子中含有4.5mol共用电子对,故最终共用电子对数在3mol~4.5mol之间,即共用电子对数目为在3NA~4.5NA之间,故B错误;
C.2.8g聚乙烯中含有0.2mol最简式CH2,含有0.2mol碳原子,含有的碳原子数为0.2NA,故C正确;
D.苯分子中碳碳键为介于单键和双键间的一种独特的键,苯分子中不存在碳碳双键,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】勒夏特列原理在生产生活中有许多重要应用。完成下列填空:
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止________________________。
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)![]() H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是_______________________。
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是_________(选填编号)。
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一定条件下。向A、B两个恒容密闭容器中分别加入等量的X,发生反应2X(g)![]() 2y(g)+z(g)测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法不正确的是( )
2y(g)+z(g)测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法不正确的是( )

A. 若A、B容积相同,但反应温度不同,且温度:A>B
B. 若A、B反应温度相同,但容积不同,且容积:A<B
C. a,c两点对应的平均相对分子质量:a>c
D. t1t2时间段内,A、B两容器中平均反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下的可逆反应:A(s)+2B(g) ![]() 2C(g)+D(g) △H<0,在甲容器充入2molA、2molB并保持压强不变,乙容器充入2molC、 1mol D并保持体积不变,起始时甲、乙两容器气体体积相等。为使平衡时两容器中B的浓度相等,下列措施不可行的是
2C(g)+D(g) △H<0,在甲容器充入2molA、2molB并保持压强不变,乙容器充入2molC、 1mol D并保持体积不变,起始时甲、乙两容器气体体积相等。为使平衡时两容器中B的浓度相等,下列措施不可行的是
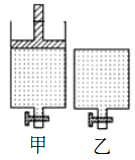
A. 乙容器中分离出一定量的D气体
B. 向甲谷器中再充入一定量的B气体
C. 将甲的活塞往下压至反应前的位置
D. 适当降低乙容器的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4可作为新型锂离子也池的正极材料。以钛铁矿(主要成分为FeTiO3、Fe2O3及少量CuO、SiO2杂质)为主要原料生产TiOSO4,同时得到的绿矾(FeSO4·7H2O)与磷酸和LiOH反应可制各 LiFePO4, LiFePO4的制备流程如下图所示:

请回答下列问题:
(1)酸溶时 FeTiO3与硫酸反应的化学方程式可表示为____________________。
(2)①加铁屑还原的目的是__________,②过滤前需要检验还原是否完全,其实验操作可描述为_________。
(3)①“反应”需要按照一定的顺序加入FeSO4溶液、磷酸和LiOH,其加入顺序应为____________________,②其理由是______________________________。
(4)滤渣中的铜提纯后可用于制取Cu2O,Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O![]() Cu2O+H2↑。则该装置中铜电极应连接直流电源的__________极,石墨电极的电极反应式为____________________,当有0. 1mol Cu2O生成时电路中转移__________mol电子。
Cu2O+H2↑。则该装置中铜电极应连接直流电源的__________极,石墨电极的电极反应式为____________________,当有0. 1mol Cu2O生成时电路中转移__________mol电子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,几种物质的pH和浓度如下表所示.回答下列问题:

(1)c1___(填“>“'<C”或“=“)c2.
(2)溶液中水的电离程度②___(填“>“'<”或“=“)③.
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为___(填序号).
(4)①溶液与④溶液等体积混合,溶液的pH___(填“>“'<“或“=”,下同)7;用④溶液滴定①荣而言,滴定过程中不可能出现的结果是___
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合图像的是 ( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com