
有关合金的叙述错误的是 ( )。
A.铁与非金属氯、氧等很难形成合金
B.合金是混合物
C.合金具有固定的熔点
D.形成合金后,其熔点比各成分的熔点都高
科目:高中化学 来源: 题型:
1)请写出下列物质的结构简式:
① 2-甲基-3-乙基戊烷: ;
② 2,3-二甲基-1-丁烯: 。
(2)请写出下列物质的名称:
 ① ② CH2CH3
① ② CH2CH3
 CH3—CH—CH2—CH—CH3
CH3—CH—CH2—CH—CH3 
 CH3—C—CH2CH3
CH3—C—CH2CH3
CH3 CH2CH3 CH2CH3
(3)在有机反应中,反应条件尤为重要。条件(如温度、溶剂、催化剂等)改变,反应产物可能会随之改变。
① 已知苯与浓硝酸、浓硫酸的混合物在50-60℃反应时生成硝基苯;若反应条件升温至100-110℃时,反应的化学方程式为 。
② 卤代烃与碱反应时,溶剂不同则产物不同。若溴乙烷与氢氧化钾的水溶液反应,反应的化学方程式为: 。
③甲苯能与溴蒸汽在光照条件下发生反应生成一溴代物,反应的化学方程式为: 。
(4)某有机分子结构如下:
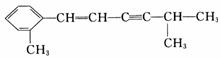
该分子中至少有 个C原子在同一平面,最多有 个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解V L ASO4的水溶液,当阴极上有m g金属析出(阴极上无气体产生)时,阳极上产生x L气体(标准状况),同时溶液的pH由原来的6.5变为2.0(设电解前后溶液体积不变)。则A的相对原子质量的表示式为( )
①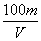 ②
②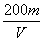 ③
③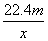 ④
④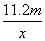
A.①② B.②④ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
关于聚四氟乙烯的下列说法中,错误的是 ( )。
A.能够耐强酸、强碱甚至“王水”的腐蚀
B.摩擦系数小,极其光滑,可以减少与雪或水的摩擦力
C.由单体发生缩聚反应而制得的
D.耐高温又耐低温,绝缘性好,在水中也不会被浸湿或膨胀
查看答案和解析>>
科目:高中化学 来源: 题型:
1 mol有 机物A(分子式为C6H10O4)经水解得1 mol B和2 mol C,C经分子内脱水得D,D可发生加聚反应生成CH2—CH2,由此可知A为
机物A(分子式为C6H10O4)经水解得1 mol B和2 mol C,C经分子内脱水得D,D可发生加聚反应生成CH2—CH2,由此可知A为
( )。
A.HOOC(CH2)4COOH B.HOOC(CH2)3COOCH3
C .CH3COO(CH2)2COOCH3 D.CH3CH2OOC—COOCH2CH3
.CH3COO(CH2)2COOCH3 D.CH3CH2OOC—COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
聚四氟乙烯的耐热性和化学性质的稳定性都超过了其他材料,号称“塑料王”。在工业生产上有广泛的应用,其合成路线如图所示:
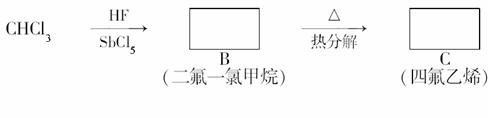
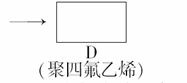
(1)在方框内填写合适的有机物的结构简式。
(2)写出下列反应的化学方程式:
B―→C________________________________________________________________________;
C―→D________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:按下图装置进行实验。并回答以下问题。
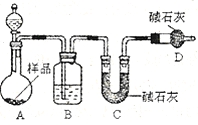
① 实验前先 。分液漏斗中应该装 (“盐酸”或“硫酸”)。D装置的作用是 。
② 实验中除称量样品质量外,还需称 装置前后质量的变化。
③ 根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤洗涤,干燥沉淀,称量固体质量,计算:
① 过滤操作中,除了烧杯,漏斗外,还用到的玻璃仪器有 。
② 实验中判断沉淀是否完全的方法是 。
③ 已知称得样品21.2g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com