
分析 ①复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料;
②材料分为金属材料、无机非金属材料、合成材料和复合材料、有机合成高分子材料,利用题干提供的信息结合相关的化学知识即可解题.
解答 解:①a.有机玻璃是化学合成的一种塑料,外观颇似玻璃,属于合成材料;
b.钢化玻璃属于硅酸盐材料,属无机非金属材料;
c.玻璃钢是玻璃纤维与合成材料复而成的一种特殊材料,属于复合材料;
d.石英玻璃的主要成分是二氧化硅,属无机非金属材料;
故答案为:c;
②尼龙含有碳元素,属于有机化合物,属于有机高分子材料,故答案为:a.
点评 本题考查无机非金属材料,为基础性习题,把握物质的性质及物质的组成为解答的关键,注重基础知识的考查,题目难度不大.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧 | B. | NaOH溶液滴入NH4HCO3溶液 | ||
| C. | 稀硝酸中加入铁粉 | D. | 镁与H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓ | |
| B. | FeCl3+3NaOH=Fe(OH)3↓+3NaCl | |
| C. | Fe2(SO4)3+3Ba(OH)2=2Fe(OH)3↓+3BaSO4↓ | |
| D. | FeCl2+2KOH=Fe(OH)2↓+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
| C(s) | H2O(g) | H2(g) | |||
| 甲 | 2 | T1 | 2 | 4 | 3.2 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 质子数=Z+A | C. | 所含电子数=Z+n | D. | 所含中子数=A-Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片上有气泡产生,发生还原反应 | B. | 锌是负极,发生还原反应 | ||
| C. | 电流方向是从锌片沿导线流向铜片 | D. | 铜片逐渐溶解,被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
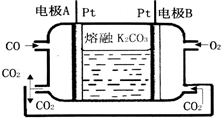 碳及其化合物与人类生产、生活密切相关.
碳及其化合物与人类生产、生活密切相关.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
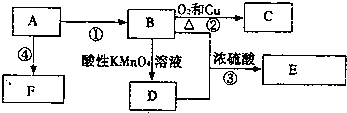

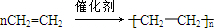 ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com