
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为______________________(写出一种即可)。
(2)25℃ 101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无无CH4和O2剩余且无固体物质生成,装置内气体全部通入足量的碱石灰后,剩余bmol气体。则:
①反应开始时CH4与O2的物质的量之比为___________________________。
②若已知 C(s) + O2(g) = CO2(g) △H1= -m kJ/mol
CO2(g) + C(s) = 2CO(g) △H2= +n kJ/mol
则表示CH4燃烧热的热化学方程式为_____________________________________________。
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应,
NO+NO2+Na2CO3===2NaNO2+CO2,2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为____________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是___________________。
(4)氮的固定是几百年来科学家一直研究的课题
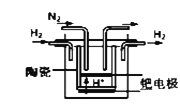
①20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如图所示,正极的电极反应式是___________________________________。
②近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)≒4NH3(g)+3O2(g),则其反应热△H=________________。
(已知:N2(g)+3H2(g)≒2NH3(g)△H=﹣92.4kJ.mol﹣1,2H2(g)+O2(g)≒2H2O(l) △H=﹣571.6kJ.mol﹣1 )
【答案】 (NH4)3PO4或(NH4)2HPO4或NH4H2PO4 ![]()
![]()
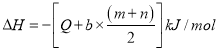 1∶7 对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应 N2+6e﹣+6H+=2NH3 +1530 kJmol﹣1
1∶7 对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应 N2+6e﹣+6H+=2NH3 +1530 kJmol﹣1
【解析】(1)由题意可知,用氨水吸收烟气中的SO2后可以得到亚硫酸铵或亚硫酸氢铵溶液,再与磷酸反应,可以生成(NH4)3PO4或(NH4)2HPO4或NH4H2PO4,故该复合肥料可能的化学式为(NH4)3PO4或(NH4)2HPO4或NH4H2PO4。
(2)25℃ 101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无CH4和O2剩余且无固体物质生成,装置内气体全部通入足量的碱石灰后,剩余bmol气体,则剩余的气体一定是CO。
①1molCH4完全燃烧需要2mol O2,当其中b molCH4不完全燃烧生成bmol CO时,实际消耗(2-![]() )mol O2,所以,反应开始时CH4与O2的物质的量之比为
)mol O2,所以,反应开始时CH4与O2的物质的量之比为![]() 。
。
②已知① C(s) + O2(g) = CO2(g) △H1= -m kJ/mol;②CO2(g) + C(s) = 2CO(g) △H2= +n kJ/mol。根据盖斯定律,由①-②可得,2CO(g) + O2(g) = 2CO2(g) ![]() ,所以,bmol CO完全燃烧可以放出
,所以,bmol CO完全燃烧可以放出![]() 的热量,则CH4燃烧热的热化学方程式为
的热量,则CH4燃烧热的热化学方程式为![]()
 。
。
(3)① 由NO+NO2+Na2CO3===2NaNO2+CO2可知,1mol NO和1mol NO2被Na2CO3溶液完全吸收后溶液质量增加32g,同时产生1mol CO2;由2NO2+Na2CO3===NaNO2+NaNO3+CO2可知, 2mol NO2被Na2CO3溶液完全吸收后溶液质量增加48g,同时产生1mol CO2。用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则有n(NO)+n(NO2)=2mol(N的物质的量是C的2倍),32g/mol![]() n(NO)+48 g/mol
n(NO)+48 g/mol![]() [n(NO2)- n(NO)]=44g,则混合气体中n(NO) =0.25mol、n(NO2)=1.75mol,所以,NO和NO2的体积比为1:7。
[n(NO2)- n(NO)]=44g,则混合气体中n(NO) =0.25mol、n(NO2)=1.75mol,所以,NO和NO2的体积比为1:7。
② 由于NO不能与Na2CO3溶液反应,所以,用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是:对于含NO较多混合气体无法完全吸收,因为NO不能与Na2CO3溶液反应。
(4)①由原电池原理可知,氢气在负极上发生氧化反应生成氢离子,氮气在正极上发生还原反应,正极的电极反应式是N2+6e﹣+6H+=2NH3。
②已知:①N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1,②2H2(g)+O2(g)2H2O(l) △H=﹣571.6kJmol﹣1 。由①![]() ②
②![]() 可得2N2(g)+6H2O(l)4NH3(g)+3O2(g),则其反应热△H=(﹣92.4kJ
可得2N2(g)+6H2O(l)4NH3(g)+3O2(g),则其反应热△H=(﹣92.4kJ![]() )
)![]() =+1530 kJmol﹣1。
=+1530 kJmol﹣1。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】锌和二氧化锰是电池工业中主要原料,其中一种Zn﹣MnO2同槽电解的工业生产试验工艺流程涉及的主要反应有: ①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法正确的是( )
A.①中MnO2是氧化剂,ZnSO4是还原产物
B.①中每产生16gS时转移电子的物质的量为2mol
C.按照②电解时,生成MnO2的电极为阴极
D.该工艺流程中H2SO4可循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃分子中的C%越大
C. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4;否则y<4
D. 相同质量的烃,完全燃烧,消耗O2越多,烃中含H%越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃0. 1mol 跟 0..2mol 氯化氢加成,其加成产物又可被0. 8mol 氯气完全取代, 该烃可能是( )
A. 丙烯 B. 1﹣丁烯 C. 丙炔 D. 2﹣丁炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
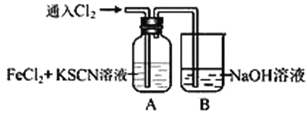
(1)B中反应的离子方程式是________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________。
(3)资料显示:SCN -的电子式为 ![]() 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
②甲同学通过实验证明了SCN―中氮元素转化为NO3―,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________mol。
Ⅱ. 8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN―被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式:____________________________________。
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式方式为____________________________。
②(CN)2和NaOH溶液反应的离子反应方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
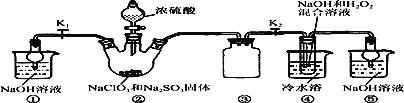
(1)装置③的作用是__________________________。
(2)装置②中产生ClO2的化学方程式为_______________________________________;装置④中制备NaClO2的离子方程式为____________________________________________。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55 ℃蒸发结晶;② 趁热过滤;③________________;④ 低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)配制待测液时,除用到烧杯、玻璃棒外,还必须用到的玻璃仪器有_________。
(5)该样品中NaClO2的质量分数为__________________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B ![]() 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( ) ①原混和气体的体积为1.2V升;
2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( ) ①原混和气体的体积为1.2V升;
②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升;
④反应达平衡时气体B消耗掉0.05V升.
A.②③
B.②④
C.①③
D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com