
| A、2 4 3 2 2 6 |
| B、0 2 1 0 1 2 |
| C、2 0 1 2 0 2 |
| D、2 10 6 2 5 12 |
| x |
| n |
| 3 |
| 2 |
| x |
| n |
| x |
| n |
| 3 |
| 2 |


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:
| A、土壤中离子的吸附和交换过程,有保肥作用 |
| B、将植物油倒入水中用力搅拌形成油水混合物 |
| C、一束平行光线射入蛋白质溶液里,可以看到一条光亮的通路 |
| D、氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 过氧乙酸 本品包括甲、乙两种溶液,体积各500mL,把甲、乙溶液各1份在玻璃容器中混合后放置24小时后,其中过氧乙酸浓度不少于10%,应用50倍纯水稀释(浓度为0.2%)稀释后才能使用. |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、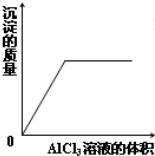 AlCl3溶液滴入NaOH溶液中 |
B、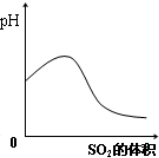 SO2气体通入氢硫酸中 |
C、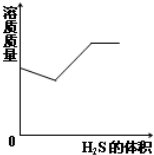 H2S气体通入NaOH溶液中 |
D、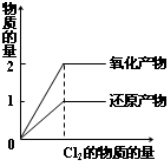 在一定量的H2S水溶液中逐渐通入Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | 2- 3 |
A、Al3+、Mg2+、S
| ||||
B、Mg2+、Na+、C
| ||||
C、Al3+、Na+、S
| ||||
D、Al3+、C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定没有NH4+、HCO3-、Ba2+ |
| B、可能有K+、Cl-、HCO3- |
| C、肯定有Al3+、Mg2+、SO42-、NH4+ |
| D、若另取部分原溶液加入足量AgNO3溶液有白色沉淀生成,证明原溶液中一定有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com