
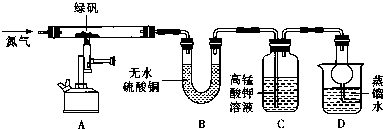
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
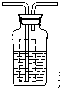 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3分析 (1)猜想1:非金属氧化物为SO2
猜想2:非金属氧化物SO3
猜想3:非金属氧化物SO2、SO3
(2)固体呈红棕色,生成了氧化铁,无水硫酸铜白色粉末遇水变蓝,二氧化硫能使高锰酸钾溶液褪色;
(3)运用质量守恒定律,硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物,三氧化二铁是红棕色固体,能和稀盐酸反应生成可溶性的黄色物质来解答此题;
(4)据硫酸根离子的检验,瓶中物质应为氯化钡溶液;
(5)绿矾高温分解生成氧化铁,二氧化硫,三氧化硫和水,结合原子守恒和电子守恒配平书写.
解答 解:(1)依据硫元素化合价变化结合电子守恒分析,
猜想1:非金属氧化 物为SO2
猜想2:非金属氧化物SO3
猜想3:非金属氧化物SO2、SO3
故答案为:非金属氧化物SO2、SO3;
(2)固体呈红棕色,生成了氧化铁,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液为氯化铁溶液,据无水硫酸铜白色粉末遇水变蓝,二氧化硫能使高锰酸钾溶液褪色,可否认猜想中的2,得到结论为:分解产生H2O、Fe2O3、SO2,
故答案为:分解产生H2O、Fe2O3、SO2;
(3)根据质量守恒定律,化学反应前后元素原子的种类个数不变,因每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2,若只生成Fe2O3和SO2,S和O之比为1:3.5,元素不守恒,故可通过理论分析得出:绿矾分解还生成另一物质SO3,
故答案为:每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2,若只生成Fe2O3和SO2,S和O之比为1:3.5,元素不守恒,故可通过理论分析得出:绿矾分解还生成另一物质SO3;
(4)虚线方框装置中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊,
装置图为: 瓶内为0.5mol/L的BaC12溶液,
瓶内为0.5mol/L的BaC12溶液,
故答案为: 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成;
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成;
(5)绿矾高温分解生成氧化铁,二氧化硫,三氧化硫和水,结合原子守恒和电子守恒配平书写得到化学方程式为:2FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O,
故答案为:2FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O.
点评 本题考查了物质存在和性质的实验探究方法和实验设计判断,氧化还原反应和盐类水解的分析应用是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 由于共价键具有方向性,共价化合物在形成晶体时均采取“紧密堆积” | |
| D. | 反应NH4Cl (s)═NH3(g)+HCl(g)室温下不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
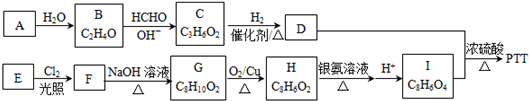
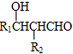
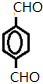 +4Ag(NH3)2OH$\stackrel{水浴}{→}$
+4Ag(NH3)2OH$\stackrel{水浴}{→}$ +4Ag↓+6NH3+2H2O.
+4Ag↓+6NH3+2H2O. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应①配平后,H2O的化学计量数为4 | |
| B. | 若反应②有2mol电子发生转移,则生成1molNO3- | |
| C. | 反应③中生成物X为CO32- | |
| D. | 1L废水完全脱氮所需CH3OH的质量为0.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
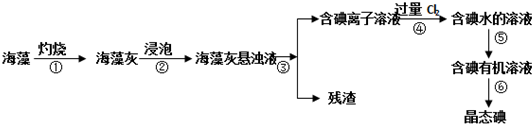
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 原文 | 水火既济而土和 | 以曾青凃铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 |
| 解释 | 黏土烧结成陶瓷 | 金属的置换 | 物质间转化的可逆性 | 重结晶方法提纯物质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
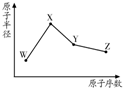 R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.
R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强. ,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);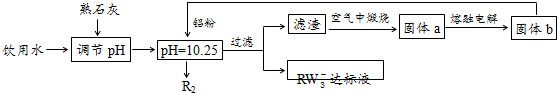
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
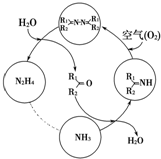 利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).
利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com