
����Ŀ���ʰ�������![]() ��һ�ֲ���ǿ�����㷺����ȱ����ƶѪ��Ԥ�������ơ�ijѧϰС������������������Һ��ʰ��ᷴӦ�Ʊ��ʰ����������й��������������
��һ�ֲ���ǿ�����㷺����ȱ����ƶѪ��Ԥ�������ơ�ijѧϰС������������������Һ��ʰ��ᷴӦ�Ʊ��ʰ����������й��������������
�ʰ���( | ������ | �ʰ������� |
������ˮ�������Ҵ������Ի����� | ������ˮ���Ҵ�����ǿ���Ժͻ�ԭ�� | ������ˮ���������Ҵ� |
ʵ�����
ʵ��1�Ʊ�![]() ������
������![]() ����Һ��
����Һ��![]() ��Һ��ϣ���Ӧ��������˲�ϴ�ӳ�����
��Һ��ϣ���Ӧ��������˲�ϴ�ӳ�����
ʵ��2�Ʊ�![]() ��
��
ʵ��װ����ͼ(�гֺͼ���������ʡ��)����ʵ��1�õ��ij����ͺ�![]() �ʰ����ˮ��Һ��Ϻ����
�ʰ����ˮ��Һ��Ϻ����![]() �С�����
�С�����![]() �еķ�Ӧ��
�еķ�Ӧ��![]() �п����ž������ŵ�����������Һ�����ȡ�
�п����ž������ŵ�����������Һ�����ȡ�
ʵ��3�ᴿ![]() ����Ӧ�������������Һ����Ũ���������Ҵ������ˡ�����õ���Ʒ��
����Ӧ�������������Һ����Ũ���������Ҵ������ˡ�����õ���Ʒ��
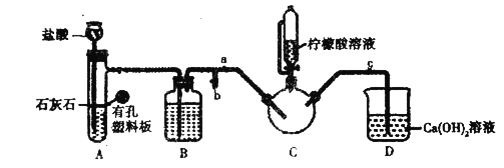
(1)д��ʵ��1���Ʊ�![]() �����ӷ���ʽ_________________��
�����ӷ���ʽ_________________��
(2)װ���������������__________��װ��![]() �е��Լ���__________��
�е��Լ���__________��
(3)ʵ��2�У���![]() �ر�
�ر�![]() ���ž�������ȷ��
���ž�������ȷ��![]() �п����ž���ʵ��������________________���ž���������е�ʵ�������________�����ŵ�����������Һ�����ȡ�
�п����ž���ʵ��������________________���ž���������е�ʵ�������________�����ŵ�����������Һ�����ȡ�
(4)ʵ��2�е�����ɵ�����Һ![]() ����ϵ
����ϵ![]() ����ʵĹ�ϵ���
����ʵĹ�ϵ���
ʵ�� | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
��ϵ | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
����(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() ���Ͳ����½���ԭ����________________________������������û���_______��
���Ͳ����½���ԭ����________________________������������û���_______��
(5)ʵ��3�м����Ҵ���Ŀ����____________________��
(6)����Ʒ������Ϊ![]() �������Ϊ__________________%��
�������Ϊ__________________%��
���𰸡�![]() ����©�� ����̼��������Һ
����©�� ����̼��������Һ ![]() �г���ʯ��ˮ����� ��
�г���ʯ��ˮ����� ��![]() �ر�
�ر�![]()
![]() ���ͣ������ӻ���ʰ����еİ�����Ӧ ��ֹ�������ӱ����� ���ٸʰ����������ܽ�������ʹ��ᾧ���� 80.00
���ͣ������ӻ���ʰ����еİ�����Ӧ ��ֹ�������ӱ����� ���ٸʰ����������ܽ�������ʹ��ᾧ���� 80.00
��������
FeSO4��Һ��NH4HCO3��Һ��Ӧ�Ʊ�FeCO3��������FeCO3��ͺ�0.20mol�ʰ����ˮ��Һ��Ϻ����C�У�Ȼ������A�еķ�Ӧ��C�п����ž������ŵ�����������Һ�����ȣ���Ӧ��������ˣ���Һ�������ᾧ�����ˡ�ϴ�ӡ������õ���Ʒ��
��1��������������̼��������ӷ�Ӧ����̼����������
��2�����������ṹ���������װ��B�Լ���Ŀ���dz�ȥ������̼�е��Ȼ��⣻
��3������ʵ��������������������
��4��NH2CH2COOH�еİ��������������ӽ�ϣ��ݴ˷�������������ǿ���Ժͻ�ԭ�ԣ�
��5�����ݸʰ�������������ˮ���������Ҵ�������
��6���������⣬FeCO3������0.20mol�ʰ��ᷴӦ��ȫ�����������غ��й�ϵʽ��2NH2CH2COOH����NH3CH3COO��2Fe���������ϵõ��ģ�NH3CH3COO��2Fe�����ʵ���Ϊ![]() n��NH2CH2COOH��=0.10mol������Ϊ0.01mol��204g/mol=20.4g���ݴ˼��㡣
n��NH2CH2COOH��=0.10mol������Ϊ0.01mol��204g/mol=20.4g���ݴ˼��㡣
��1��Fe2����HCO3��������Ӧ����FeCO3������CO2��H2O�����ӷ���ʽΪ��Fe2++2HCO3��=FeCO3��+CO2��+ H2O���ʴ�Ϊ��Fe2++2HCO3��=FeCO3��+CO2��+ H2O��
��2��װ���������Ϊ����©�����Լ�B��Ҫ��Ϊ�˳�ȥ������̼�е��Ȼ��⣬��Ϊ����̼��������Һ���ʴ�Ϊ������©��������̼��������Һ��
��3����C�г���CO2��CO2��ʼ����D�У�ʹD�еij���ʯ��ˮ����ǣ���ʱ˵��C�п����Ѿ��ž����ʴ�Ϊ��D�г���ʯ��ˮ����ǣ�����A�еķ�Ӧ��C�п����ž���![]() �ر�
�ر�![]() ���ŵ�����������Һ�����ȣ��ʴ�Ϊ��
���ŵ�����������Һ�����ȣ��ʴ�Ϊ��![]() �г���ʯ��ˮ����ǣ���
�г���ʯ��ˮ����ǣ���![]() �ر�
�ر�![]() ��
��
��4��NH2CH2COOH�еİ����Լ��ԣ�pH����ʹ�����½���ԭ����H+����NH2CH2COOH��Ӧ��������Ϣ����������л�ԭ�Ժ�ǿ���ԣ��ܹ��ٽ�FeCO3���ܽ⣬��ֹFe2����������
�ʴ�Ϊ��![]() ���ͣ������ӻ���ʰ����еİ�����Ӧ����ֹ�������ӱ�����
���ͣ������ӻ���ʰ����еİ�����Ӧ����ֹ�������ӱ�����
��5�����ڸʰ�������������ˮ���������Ҵ�����Ϊ���ʰ����������ܽ�ȣ���߲��ʺʹ��ȣ����Ҵ�ϴ�ӣ��ʴ�Ϊ�����ٸʰ����������ܽ�������ʹ��ᾧ������
��6���������⣬FeCO3������0.20 mol�ʰ��ᷴӦ��ȫ,���������غ��й�ϵʽ��2NH2CH2COOH(NH3CH3COO)2Fe��
�������ϵõ���(NH3CH3COO)2Fe�����ʵ���Ϊ12n(NH2CH2COOH)=0.10
�����Ϊ��![]() =80.00%���ʴ�Ϊ��80.00%��
=80.00%���ʴ�Ϊ��80.00%��


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������mgij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪMg/mol���������ӵ�������NA��ʾ����
��1������������ʵ���Ϊ________mol��
��2������������ԭ������Ϊ_________����
��3���������ڱ�״���µ����Ϊ_________L��
��4������������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��Ϊ_________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���(![]() )���ִ���ҵ����Ҫ����ԭ�ϣ��������õĿ����ԣ���ʴ���ܳ����ѡ����Ӣʯ(��Ҫ�ɷ���
)���ִ���ҵ����Ҫ����ԭ�ϣ��������õĿ����ԣ���ʴ���ܳ����ѡ����Ӣʯ(��Ҫ�ɷ���![]() ������������
������������![]() ������)Ϊԭ������ﯼ��仯�����������ͼ��ʾ
������)Ϊԭ������ﯼ��仯�����������ͼ��ʾ

(1)д��![]() �ĵ���ʽ____________________��
�ĵ���ʽ____________________��
(2)�������������У���������ʧ�����ַ����õ���![]() ����ͨ�����ɴ�
����ͨ�����ɴ�![]() �����ķ�Ӧ�õ���
�����ķ�Ӧ�õ���![]() �������û�ѧ����ʽ������ԭ��_________________________��
�������û�ѧ����ʽ������ԭ��_________________________��
(3)����������Ĺ��������̼�⣬����![]() ��
��![]() ����ˮ��ȡ���Ȼ�����Һ�����ˣ��������з����̼��
����ˮ��ȡ���Ȼ�����Һ�����ˣ��������з����̼��![]() ���ֹ���ķ�����____________________��
���ֹ���ķ�����____________________��
(4)д������������![]() ��ˮ��Ӧ�Ļ�ѧ����ʽ��____________________________��
��ˮ��Ӧ�Ļ�ѧ����ʽ��____________________________��
(5)��֪�����(![]() )��һ��������������������ƹ����ڿ��γ����Σ���д����ѧ����ʽ_________________________________________��
)��һ��������������������ƹ����ڿ��γ����Σ���д����ѧ����ʽ_________________________________________��
(6)��ҵ�Ͽ��üػ�ԭ![]() ʱ�Ƶý���
ʱ�Ƶý���![]() ��
��![]() ����ԭʱ���ɵļ��ε����ʵ���Ϊ_________________��
����ԭʱ���ɵļ��ε����ʵ���Ϊ_________________��
(7)��֪![]() ��
��![]() ������˵����ȷ����__________
������˵����ȷ����__________
A��![]() ���������Һ��
���������Һ��![]() ��
��![]() ֮�;�Ϊ14
֮�;�Ϊ14
B��������ζ�ijŨ�ȵ�![]() ��Һ���ζ�������
��Һ���ζ�������![]() ������
������
C��![]() ��Һ����μ���������Һ���μӹ�����
��Һ����μ���������Һ���μӹ�����![]() ��С
��С
D��ij�¶���![]() ��������Һ��
��������Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ZrO2����Ҫ�����²��ϣ��������մ��ڹ������Ȼ�Ӣʯ(ZrSiO4)������������ͭ�Ƚ���Ԫ�ص����������ʣ���ҵ���ӢʯΪԭ���Ʊ�ZrO2�Ĺ����������£�

��֪��Fe(SCN)3������MIBK�� Zr(SCN)4��ˮ���ܽ�Ȳ���������MIBK��
(1)�Ӣʯ���Ԫ�صĻ��ϼ�Ϊ____________��
(2)�Ȼ�����Ӧ��ZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) ��H<0��ZrC14�IJ������¶ȱ仯��ͼ��ʾ����ͼ��֪�Ȼ������������_________���Ȼ�����ZrC14�IJ������¶�������������С��ԭ���� __________��
ZrCl4(g)+SiCl4(g)+2CO2(g) ��H<0��ZrC14�IJ������¶ȱ仯��ͼ��ʾ����ͼ��֪�Ȼ������������_________���Ȼ�����ZrC14�IJ������¶�������������С��ԭ���� __________��

(3)д��A12O3�����Ȼ�������ת��ΪAlC13�Ļ�ѧ����ʽ___________________��
(4)Na2S��H2S��NaCN�Ⱦ�Ϊ���õ�ͭ��������������ʹ��NaCN��ͭ��������Na2S��H2S��ԭ����__________�������ӷ���ʽ���ͣ����������ܽ����Һ��c(Cu2+)=0.01mol/L������Һ��Cu2+��ʼ����ʱ��c(CN-)= ___________��(��֪Ksp[Cu(CN)2]=4.00��10-10)
(5)ʵ���ҽ�����ȡ�ͷ���ȡ��������_______����������ȡ�뷴��ȡ��Ŀ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���ص�ʾ��ͼ��ͼ��ʾ������˵����ȷ����

A. �ŵ�ʱ��NΪ��������缫��Ӧʽ��PbO2+SO42-+4H++2e-=PbSO4+2H2O
B. �ŵ�ʱ��c(H2 SO4)���䣬��������������
C. �ŵ�ʱ��SO42-��M.N�����缫�ƶ�
D. �ŵ�ʱ��������Ӧʽ��PbSO4+2e-=Pb+SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ������д�������(����)
A.̼������Һ��ϡ�������� CO32��+2H+=H2O+CO2��
B.����ͭ��Һ�еμ��ռ���Һ�� Cu2++2OH��=Cu(OH)2��
C.��CO2ͨ������������������Һ���� 2OH��+CO2=CO32��+H2O
D.������Һ�м���Ba(OH)2��Һ�� Ba2++ SO![]() ��=BaSO4��
��=BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��Ԫ��(Carbon group)����̼(C)����(Si)����(Ge)����(Sn)��Ǧ(Pb)���a(Fl)���֡�
(1)��֪SnΪ50��Ԫ�أ���۵����Ų�ʽΪ ______���۵����гɶԵ�����Ϊ______����
(2)��֪CO��N2�Ľṹ���ƣ���CO�ĵ���ʽΪ______��C��O��N��һ�������ɴ�С��˳��Ϊ______����������⻯����۷е�ߵ�˳��Ϊ ______(������ѧʽ����ʾ����
(3)����(SiH4)��������ȡ�����뵼��裬��ҵ�ϲ���Mg2Si��NH4Cl��Һ�������з�Ӧ�Ƶü��飬�÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(4)̼�����Ƶ��ܽ��С��̼���ƣ�������HCO3-�ܹ��γ�˫�ۻ�����״���ӵĽ����HCO3-��Cԭ�ӵ��ӻ���ʽΪ_______��HCO3-�ܹ�˫�ۻ��۵�ԭ����__________��
(5) SiC��ΪC��SiΨһ�ȶ��Ļ����ÿ��Si(��C)ԭ�����ܱ߰�Χ��C(Si)ԭ��ͨ��________�ӻ����ϡ��Ѿ�����SiC����250�������塣ij����ϵ�����侧������Ϊapm�������ӵ�������ֵΪNA���þ�����ԭ�ӵ��������Ϊ��
C����ԭ�ӣ�(0��0��0)��(![]() ��
��![]() ��0)��(
��0)��(![]() ��0��
��0��![]() )��(0��
)��(0��![]() ��
��![]() )
)
Siȫ��ԭ�ӣ�(![]() ��
��![]() ��
��![]() )��(
)��(![]() ��
��![]() ��
��![]() )��(
)��(![]() ��
��![]() ��
��![]() )��(
)��(![]() ��
��![]() )
)
������������Siԭ�ӹ��ɵĿռ乹��Ϊ_______��������ܶȿɱ�ʾΪ________g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�ζ����������һ�ִӻ���������ȡ��ˮ�����ӷ����㾫�ͣ������Ҵ������ѵ��л��ܼ���������ͼ��ʾװ�ô��������ѷۣ��������ᴿ�õ������͡�

ʵ�鲽�裺
��һ����Aװ���е�Բ����ƿ��װ��![]() �ݻ���ˮ����1~2����ʯ��ͬʱ����B�е�Բ����ƿ�м���20g�����ѷۺ�50mLˮ��
�ݻ���ˮ����1~2����ʯ��ͬʱ����B�е�Բ����ƿ�м���20g�����ѷۺ�50mLˮ��
����������Aװ���е�Բ����ƿ�����д�����������ʱ�رյ��ɼУ���������
�����������Һ�м���ʳ�������ͣ�����15mL������ȡ2�Σ���������ȡ���Ѳ�ϲ�������������ˮNa2SO4����Һ���㵹��������ƿ�У�����û����͡�
(1)װ��A�в����ܵ�������_______��װ��B��Բ����ƿ��б��Ŀ���� ________��
(2)���裨�����У����۲쵽_______����ʱ����ֹͣ�����������ʱ�����в�����˳��Ϊ_______�����ţ���
��ֹͣ���Ȣڴ��ɼТ۹ر�����ˮ
(3)�����Һ�м���ʳ�ε�������__ ��������ˮNa2SO4��������_______��
(4)ʵ���������ϡNaOH��Һ��ϴ�����ܣ���Ӧ�Ļ�ѧ����ʽΪ_________������������![]() ��ʾ��
��ʾ��
(5)Ϊ�ⶨ����������֬�ĺ�����ȡ20.00mL�����������Ҵ��У���80.00mL0.5mol/LNaOH���Ҵ���Һ�����裬��ַ�Ӧ����ˮ���200mL��Һ��ȡ25.00mL�����̪����0.1moI/L������еζ����ζ��յ���������20.00mL����û������к�����֬_______ g/L��
���� �ƣ�ʽ����884)��
�ƣ�ʽ����884)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ������Һ��������ȷ����(����)
A. �����£�pH��7��NH4Cl�백ˮ�Ļ����Һ������Ũ�ȴ�С˳��Ϊ:c(Cl��)>c(NH![]() )>c(H��)��c(OH��)
)>c(H��)��c(OH��)
B. ��pH��4�Ĵ�����Һϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ�����
C. �к�pH���������ͬ������ʹ�����Һ������NaOH�����ʵ�����ͬ
D. �����£�ͬŨ�ȵ�Na2S��NaHS��Һ��ȣ�Na2S��Һ��pH��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com