
°æƒø°øƒ≥Œ¬∂»œ¬£¨‘⁄“ª∏ˆ2 Lµƒ√‹±’»›∆˜÷–£¨º”»Î4 mol A∫Õ2 mol BΩ¯––»Áœ¬∑¥”¶£∫3A(g)£´2B(g)![]() 4C(s)£´D(g)£¨∑¥”¶2 min∫Û¥ÔµΩ∆Ω∫‚£¨≤‚µ√…˙≥…1.6 mol C£¨œ¬¡–Àµ∑®’˝»∑µƒ «
4C(s)£´D(g)£¨∑¥”¶2 min∫Û¥ÔµΩ∆Ω∫‚£¨≤‚µ√…˙≥…1.6 mol C£¨œ¬¡–Àµ∑®’˝»∑µƒ «
A.«∞2 min£¨Dµƒ∆Ωæ˘∑¥”¶ÀŸ¬ Œ™0.2 mol°§L£≠1°§min£≠1
B.¥À ±£¨Bµƒ∆Ω∫‚◊™ªØ¬ «40%
C.‘ˆ¥Û∏√ÃÂœµµƒ—π«ø£¨∆Ω∫‚≤ª“∆∂Ø
D.‘ˆº”B£¨∆Ω∫‚œÚ”““∆∂Ø£¨Bµƒ∆Ω∫‚◊™ªØ¬ ‘ˆ¥Û
°æ¥∞∏°øB
°æΩ‚Œˆ°ø
A£Æ∏˘æ›∑Ω≥à Ωø…÷™£¨∑¥”¶2 min∫Û¥ÔµΩ∆Ω∫‚£¨≤‚µ√…˙≥…1.6 mol C£¨‘Ú…˙≥…µƒDµƒŒÔ÷ µƒ¡øŒ™0.4 mol£¨«∞2 min£¨Dµƒ∆Ωæ˘∑¥”¶ÀŸ¬ Œ™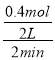 £Ω0.1 mol°§L£≠1°§min£≠1£¨—°œÓA¥ÌŒÛ£ª
£Ω0.1 mol°§L£≠1°§min£≠1£¨—°œÓA¥ÌŒÛ£ª
B£Æ∏˘æ›∑Ω≥à Ωø…÷™£¨≤Œº”∑¥”¶µƒBµƒŒÔ÷ µƒ¡øŒ™0.8mol£¨π Bµƒ◊™ªØ¬ =![]() °¡100%=40%£¨—°œÓB’˝»∑£ª
°¡100%=40%£¨—°œÓB’˝»∑£ª
C£Æ∏√∑¥”¶µƒ’˝∑¥”¶∆¯ÃÂê˝ºı–°£¨‘ˆ¥Û—π«ø∆Ω∫‚’˝œÚ“∆∂Ø£¨—°œÓC¥ÌŒÛ£ª
D£Æ‘ˆº”Bµƒ”√¡ø£¨Bµƒ≈®∂»‘ˆ¥Û£¨∆Ω∫‚œÚ’˝∑¥”¶∑ΩœÚ“∆∂Ø£¨Aµƒ◊™ªØ¬ ‘ˆ¥Û£¨Bµƒ◊™ªØ¬ ΩµµÕ£¨—°œÓD¥ÌŒÛ£ª
¥∞∏—°B°£


 ‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
| ƒÍº∂ | ∏fl÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏fl“ª | ∏fl“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏fl∂˛ | ∏fl∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏fl»˝ | ∏fl»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏fl÷–ªØ—ß ¿¥‘¥£∫ –գ∫
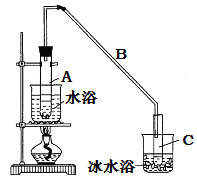
°æƒø°øƒ≥ªØ—ß–°◊È≤…”√¿‡À∆÷∆““À·““ı•µƒ◊∞÷√(»ÁÕº)£¨“‘ª∑º∫¥º÷∆±∏ª∑º∫œ©
“—÷™£∫![]()
![]()
![]() +H2O
+H2O
√‹∂»(g/cm3) | »€µ„(°Ê) | ∑–µ„(°Ê) | »‹Ω‚–‘ | |
ª∑º∫¥º | 0.96 | 25 | 161 | ƒ‹»‹”⁄ÀÆ |
ª∑º∫œ© | 0.81 | -103 | 83 | ƒ—»‹”⁄ÀÆ |
(1)÷∆±∏¥÷∆∑£∫Ω´12.5 mLª∑º∫¥ºº”»Î ‘π‹A÷–£¨‘Ÿº”»Îl mL≈®¡ÚÀ·£¨“°‘»∫Û∑≈»ÎÀÈ¥…∆¨£¨ª∫¬˝º”»»÷¡∑¥”¶ÕÍ»´£¨‘⁄ ‘π‹Cƒ⁄µ√µΩª∑º∫œ©¥÷∆∑°£
¢ŸA÷–ÀÈ¥…∆¨µƒ◊˜”√ «_________________________°£
¢⁄µºπ‹B≥˝¡Àµº∆¯Õ‚ªπæfl”–µƒ◊˜”√ «_____________°£
(2)÷∆±∏æ´∆∑£∫
¢Ÿª∑º∫œ©¥÷∆∑÷–∫¨”–ª∑º∫¥º∫Õ…Ÿ¡øÀ·–‘‘”÷ µ»°£º”»Î±•∫Õ ≥—ŒÀÆ£¨’Òµ¥°¢æ≤÷√°¢∑÷≤„£¨ª∑º∫œ©‘⁄_________≤„(ÃÓ…œªÚœ¬)£¨∑÷“∫∫Û”√_________ (Ãӻα‡∫≈)œ¥µ”°£
a.KMnO4»‹“∫ b.œ°H2SO4 c.Na2CO3»‹“∫
¢⁄‘ŸΩ´ª∑º∫œ©∞¥»ÁÕº◊∞÷√’Ù¡Û£¨¿‰»¥ÀÆ”¶¥”_________ø⁄Ω¯»Î£¨ƒøµƒ « π¿‰»¥ÀÆ”Î∆¯Ã–Œ≥…ƒÊ¡˜∑ΩœÚ°£
¢€ ’ºØ≤˙∆∑ ±£¨øÿ÷∆µƒŒ¬∂»”¶‘⁄_________◊Û”“£¨ µ—È÷∆µ√µƒª∑º∫œ©æ´∆∑÷ ¡øµÕ”⁄¿Ì¬€≤˙¡ø£¨ø…ƒ‹µƒ‘≠“Ú «__________°£
a£Æ’Ù¡Û ±¥”70 °Êø™ º ’ºØ≤˙∆∑
b£Æª∑º∫¥º µº ”√¡ø∂‡¡À
c£Æ÷∆±∏¥÷∆∑ ±ª∑º∫¥ºÀÊ≤˙∆∑“ª∆’Ù≥ˆ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏fl÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øµ™‘™ÀÿµƒªØ∫œŒÔ‘⁄π§≈©“µ“‘º∞π˙∑¿ø∆ºº÷–”√Õæπ„∑∫£¨µ´“≤ª·∂‘ª∑æ≥‘Ï≥…Œ€»æ£¨»Áµÿœ¬ÀÆ÷–œıÀ·—Œ‘Ï≥…µƒµ™Œ€»æ“—≥…Œ™“ª∏ˆ ¿ΩÁ–‘µƒª∑æ≥Œ °£ÕÍ≥…œ¬¡–ÃÓø’£∫
£®1£©…Ò÷€‘ÿ»À∑…¥¨µƒªº˝Õ∆Ω¯∆˜÷–≥£”√ά(N2H4)◊˜»º¡œ°£NH3”ÎNaClO∑¥”¶ø…µ√µΩά(N2H4)£¨∆‰À˚≤˙ŒÔ–‘÷ Œ»∂®°£∏√∑¥”¶÷–±ª—ıªØ”᪪π‘≠µƒ‘™Àÿµƒ‘≠◊”∏ˆ ˝÷Ʊ»Œ™______°£»Áπ˚∑¥”¶÷–”–5molµÁ◊”∑¢…˙◊™“∆£¨ø…µ√µΩά______g°£
£®2£©≥£Œ¬œ¬œÚ25mL1.00mol/Lœ°—ŒÀ·÷–ª∫ª∫Õ®»Î0.025molNH3(»‹“∫ê˝±‰ªØ∫ˆ¬‘≤ªº∆)£¨∑¥”¶∫Û»‹“∫÷–¿Î◊”≈®∂»”…¥ÛµΩ–°µƒÀ≥–Ú «_____°£‘⁄Õ®»ÎNH3µƒπ˝≥Ã÷–»‹“∫µƒµºµÁƒ‹¡¶____(ÃÓ–¥°∞±‰¥Û°±°¢°∞±‰–°°±ªÚ°∞º∏∫ı≤ª±‰°±)°£
£®3£©œÚ…œ ˆ»‹“∫÷–ºÃ–¯Õ®»ÎNH3£¨∏√π˝≥Ã÷–¿Î◊”≈®∂»¥Û–°πÿœµø…ƒ‹’˝»∑µƒ «_____(—°ÃÓ±‡∫≈)°£
a£Æ[Cl-]=[NH4+]>[H+]=[OH-] b£Æ[Cl-]>[NH4+]=[H+]>[OH-]
c£Æ[NH4+]>[OH-]>[Cl-]>[H+] d£Æ[OH-]>[NH4+]>[H+]>[Cl-]
£®4£©≥£Œ¬œ¬œÚ25mL∫¨HCl0.01molµƒ»‹“∫÷–µŒº”∞±ÀÆ÷¡π˝¡ø£¨∏√π˝≥Ã÷–ÀƵƒµÁ¿Î∆Ω∫‚____(ÃÓ–¥µÁ¿Î∆Ω∫‚“∆∂Ø«Èøˆ)°£µ±µŒº”∞±ÀƵΩ25mL ±£¨≤‚µ√»‹“∫÷–ÀƵƒµÁ¿Î∂»◊Ó¥Û£¨‘Ú∞±ÀƵƒ≈®∂»Œ™______mol°§L-1°£
£®5£©…˺∆¡Ω÷÷ µ—È∑Ω∞∏÷§√˜∞±ÀÆ «»ıµÁΩ‚÷ £®1£©_______£ª£®2£©_______°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏fl÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥ªÏ∫œŒÔA£¨∫¨”–KAl(SO4)2°¢Al2O3 ∫ÕFe2O3£¨‘⁄“ª∂®Ãıº˛œ¬ø… µœ÷œ¬ÕºÀ˘ 浃ŒÔ÷ ÷ƺ‰µƒ±‰ªØ£∫
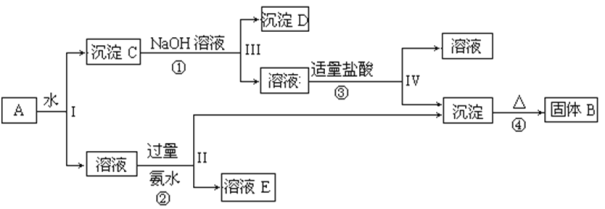
曥Àªÿ¥œ¬¡–Œ £∫
(1)I°¢II°¢III°¢IVÀƒ≤Ω÷–∂‘”⁄»‹“∫∫Õ≥¡µÌµƒ∑÷¿Î≤…»°µƒ∑Ω∑® «____________°£
(2)∏˘æ›…œ ˆøÚÕº∑¥”¶πÿœµ£¨–¥≥ˆœ¬¡–B°¢C°¢DÀ˘∫¨ŒÔ÷ µƒªØ—ß ΩπÃÃÂB _______£ª ≥¡µÌC ________ £ª ≥¡µÌD ________£ª
(3)–¥≥ˆ¢Ÿ°¢¢⁄°¢¢€µƒ¿Î◊”∑Ω≥à Ω∫Õ¢‹µƒªØ—ß∑Ω≥Ã Ω£∫
¢Ÿ__________________________________________
¢⁄_________________________________________
¢€_________________________________________
¢‹ ________________________________________
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏fl÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™»»ªØ—ß∑Ω≥à ΩC2H2(g)£´![]() O2(g)£Ω2CO2(g)£´H2O(g) °˜H=-1256kJ/mol£¨œ¬¡–Àµ∑®’˝»∑µƒ «( )
O2(g)£Ω2CO2(g)£´H2O(g) °˜H=-1256kJ/mol£¨œ¬¡–Àµ∑®’˝»∑µƒ «( )
A.““»≤µƒ»º…’»»Œ™1256kJ°§mol-1
B.»Ù…˙≥…2mol“∫èÀÆ£¨‘Ú∑≈≥ˆµƒ»»¡øŒ™2512 kJ°§mol-1
C.»Ù◊™“∆10molµÁ◊”£¨‘Úœ˚∫ƒ2.5mo1 O2
D.»Ù–Œ≥…4molú—ıπ≤”√µÁ◊”∂‘£¨‘Ú∑≈≥ˆµƒ»»¡øŒ™2512kJ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏fl÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∫∫ª∆‹ÀÀÿ «¥´Õ≥÷–≤›“©ª∆‹Àµƒ”––ß≥…∑÷÷Æ“ª£¨∂‘÷◊¡ˆœ∏∞˚µƒ…±…À”–∂¿Ãÿ◊˜”√°£œ¬¡–”– πÿ∫∫ª∆‹ÀÀÿµƒ– ˆ’˝»∑µƒ «

A. ∫∫ª∆‹ÀÀÿµƒ∑÷◊” ΩŒ™ C16H13O5
B. ∏√ŒÔ÷ ”ˆ FeCl3 »‹“∫œ‘…´
C. 1 mol ∏√ŒÔ÷ ”ΉÂÀÆ∑¥”¶£¨◊Ó∂‡œ˚∫ƒ 1 mol Br2
D. ”Î◊„¡ø H2 ∑¢…˙º”≥…∑¥”¶∫Û£¨∏√∑÷◊”÷–πŸƒ‹Õ≈µƒ÷÷¿‡ºı…Ÿ 1 ÷÷
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏fl÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»Œ∫ŒŒÔ÷ µƒÀÆ»‹“∫∂º¥Ê‘⁄ÀƵƒµÁ¿Î∆Ω∫‚£¨∆‰µÁ¿Î∑Ω≥à Ωø…±Ì 挙£∫H2OH£´£´OH-°£«Îªÿ¥œ¬¡–”–πÿŒ £∫
(1)œ÷”˚ πÀƵƒµÁ¿Î∆Ω∫‚œÚ”““∆∂Ø£¨«“À˘µ√»‹“∫≥ À·–‘£¨ø…“‘—°‘Òµƒ∑Ω∑®”–_________°£
A.º”»»÷¡100°Ê B.º”»Î NaHSO4(s) C.º”»ÎCH3COONa(s) D.º”»ÎNH4Cl(s)
(2)‘⁄t°Ê ±£¨≤‚µ√0.01mol°§L-1µƒNaOH»‹“∫µƒpH£Ω11£¨‘Ú∏√Œ¬∂»œ¬ÀƵƒ¿Î◊”ª˝Œ™_____£¨¥ÀŒ¬∂»____25°Ê(—°ÃÓ°∞¥Û”⁄°±°∞–°”⁄°±ªÚ°∞µ»”⁄°±)£¨¿Ì”… «________°£
(3)‘⁄25°Ê ±£¨Ω´pH£ΩaµƒNaOH»‹“∫VaL”ÎpH£ΩbµƒHCl»‹“∫VbLªÏ∫œ£¨«ÎÃÓ–¥œ¬¡–ø’∞◊£∫
¢Ÿ»ÙÀ˘µ√»‹“∫≥ ÷––‘£¨«“a£Ω11£¨b£Ω3£¨‘ÚVa:Vb£Ω__________°£
¢⁄»ÙÀ˘µ√»‹“∫≥ ÷––‘£¨«“Va:Vb£Ω10:1£¨‘Úa£´b£Ω__________°£
¢€»ÙÀ˘µ√ªÏ∫œ»‹“∫µƒpH£Ω10£¨«“a£Ω12£¨b£Ω2£¨‘Ú Va: Vb£Ω___________°£
¢‹»ÙΩ´pH£Ω12µƒNaOH»‹“∫VaL”ÎVbLÀƪÏ∫œ∫ÛÀ˘µ√»‹“∫µƒpH£Ω10£¨‘ÚVa:Vb£Ω____°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏fl÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»ÁÕº±Ì 挸»»∑¥”¶°¢÷√ªª∑¥”¶°¢—ıªØªπ‘≠∑¥”¶÷ƺ‰µƒπÿœµ£¨¥”œ¬¡–—°œÓ∑¥”¶÷–—°≥ˆ Ù”⁄«¯”ÚVµƒ «£® £©
![]()
A.Na2O2+2CO2=Na2CO3+O2B.NaOH+HCl=NaCl+H2O
C.2NaHO3=2Na2CO3+H2O+CO2°¸D.2Na+2H2O=NaOH+H2°¸
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏fl÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø÷–π˙ø∆—ß‘∫ø∆—–Õ≈∂”—–æø∑¢œ÷£¨‘⁄≥£Œ¬≥£—π∫Õø…º˚π‚œ¬£¨ª˘”⁄ LDH£®“ª÷÷πÃÃÂ¥flªØº¡£©∫œ≥…NH3µƒ‘≠¿Ì æ“‚Õº»ÁÕºÀ˘ æ°£œ¬¡–Àµ∑®≤ª’˝»∑µƒ «£® £©
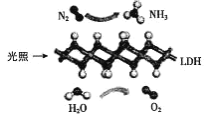
A.∏√∑¥”¶ Ù”⁄÷√ªª∑¥”¶
B.∏√π˝≥Ã÷–÷ª…ʺ∞º´–‘º¸µƒ∂œ¡—”Î…˙≥…
C.ª˘”⁄ LDH ∫œ≥… NH3µƒπ˝≥à ٔ⁄µ™µƒπÃ∂®
D.∏√π˝≥Ã÷–√ø…˙≥… 2.24L£®±Í◊º◊¥øˆ£©O2‘Ú◊™“∆ 0.4mol µÁ◊”
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒfi÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com