
NA表示阿伏加德罗常数的值,下列有关说法正确的是
A.反应KIO3+6HI=KI+3H2O+3I2 ,生成3mol I2转移电子的总数为6NA
B.标准状况下,由0.4 mol H2O2生成O2转移的电子数目为0.2NA
C.12g石墨和C60的混合物中质子总数为6NA
D.室温下,1L pH=13的NaOH溶液中,由水电离的OH- 离子数目为0.1NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:选择题
下列实验方案不合理的是
A.用加热法分离碘和氯化铵的混合物
B.用焰色反应鉴别NaCl和KCl
C.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸和乙醇
D.用KSCN溶液检验FeCl2是否已被氧化而变质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:推断题
(14分)据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。已知:
①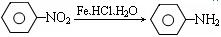 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化)
②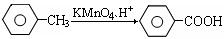
③
下面是PAS—Na的一种合成路线(部分反应的条件未注明):
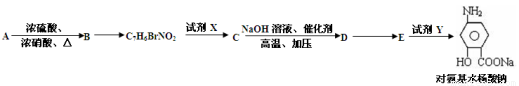
按要求回答问题:
(1)A与浓硝酸和浓硫酸的混合物可以发生取代反应,在30℃时反应主要得到B和它的一种同分异构体,在一定条件下也可以反应生成TNT,请写出由A制取TNT的化学反应方程式_________________
(2)写出各物质的结构简式C:__________________D:__________________;
(3)写出所加试剂的化学式X:__________________Y:__________________。
(4)上述合成路线中,分子式为C7H6BrNO2的官能团名称为_______________,与它具有相同官能团并属于芳香族化合物的同分异构体有__________种(含M本身)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
下列判断正确的是
A.通入足量CO2后的溶液中大量共存:Na+、SiO32-、CH3COO-、CO32-
B.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度相同
C.NH4Al(SO4)2溶液中滴加足量的NaOH的离子方程式为:NH4++ Al3++5OH-=NH3·H2O+ AlO2-+2H2O
D.Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三四月考化学试卷(解析版) 题型:简答题
(16分)X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_________________________________(填元素符号)。
(3)元素的非金属性Z____Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有____(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的氢化物反应的化学方程式为____________________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式_______________;B的水溶液不呈中性的原因____________________________(用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为_______;
(7)若使A按下列途径完全转化为F:
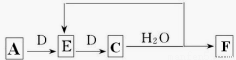
①F的化学式为_________;
②参加反应的A与整个过程中消耗D的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:填空题
(14分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
> ;
(2)A、B、C形成的化合物的晶体类型为 ;电子式为 ;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式 ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式 ;
(6)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式 .
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:选择题
下列是某学生自己总结的一些规律,其中正确的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.将Mg(HCO3)2溶液加热,最终得到Mg(OH)2沉淀,由此可知溶解度Mg(OH)2> Mg(HCO3)2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:选择题
某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。根据上述实验情况,以下说法错误的是
A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32-
B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I-
C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3-
D.向该混合溶液中滴加酚酞试液后呈红色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高三上学期第五次模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L SO3所含的氧原子数为1.5NA
B.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
C.常温常压下,4.0 g CH4中含有共价键的数目为NA
D.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com